Introdução
Ao lado das doenças neoplásicas e das alterações hepáticas, metabólicas e cardiovasculares, a doença renal atualmente é, sem dúvida, uma das principais preocupações relacionadas ao cuidado dos pacientes que vivem com HIV. Além do impacto gerado diretamente pelas alterações da função renal na saúde dos pacientes e da perda da qualidade de vida associada à doença renal terminal, em que há necessidade de tratamento dialítico até a disponibilidade de transplante renal, esses pacientes apresentam um risco aumentado de progressão para condições definidoras e óbito.1,2
Também pode ser necessário reajustar as doses de medicamentos e restringir o uso de outros, o que leva a dificuldades logísticas para a terapia antirretroviral (TARV) e as demais comorbidades. Assim, é importante que os clínicos envolvidos no atendimento a pacientes com infecção pelo HIV estejam atentos e sejam capazes de identificar a lesão renal em seu estágio inicial e abordá-la corretamente por suas múltiplas facetas, incluindo a decisão sobre a escolha da TARV adequada.
Patogenia e fatores de risco
Desde o início da epidemia, na década de 1980, foi possível registrar que um percentual significativo de pacientes com imunossupressão apresentava um tipo de nefropatia caracterizada por proteinúria expressiva e evolução para doença renal terminal, depois conhecida como HIVAN (HIV associated nephropathy).3,4
Posteriormente, identificou-se que, além dos quadros graves de HIVAN, era possível encontrar outras formas mais brandas de alterações da função renal em pacientes infectados pelo HIV. Foi reconhecida também uma grande associação de nefropatia com etnia, frequentemente encontrada em negros e raramente em caucasianos. Um polimorfismo genético presente no cromossomo 22, que daria vantagem seletiva em países da África devido a uma associação com resistência à infecção por algumas espécies de Trypanosoma, já foi relacionado à suscetibilidade de dano renal em pacientes não diabéticos e pode, até certo ponto, explicar essa tendência.5,6
Outros fatores de risco encontrados para essa condição foram baixa contagem de células CD4 e carga viral a partir de 4.000 cópias/mL.7 Por isso mesmo, a terapia antirretroviral combinada (TARC) trouxe uma extraordinária mudança na incidência e na gravidade dessa nefropatia, e é responsável por uma redução de pelo menos 30% na doença renal terminal.8 Com isso, outras formas de doença renal, que sofreram menor impacto em sua incidência e prevalência com a evolução da TARC, passaram a ser mais
frequentemente reconhecidas, como a nefropatia por IGA, a glomerulopatia membranoproliferativa associada à infecção pelo HCV e, principalmente, a nefrotoxicidade associada a medicamentos.9 O envelhecimento da população que vive com HIV também trouxe alterações no espectro da doença renal presente nesse grupo. Estudos demonstram que até 40% das pessoas com idade acima de 75 anos apresentam clearence de creatinina significativamente reduzido, isto é, abaixo de 60 mL/min.10 Além disso, patologias classicamente associadas ao acometimento renal, como a hipertensão e o diabetes, tornam-se mais prevalentes com o aumento da faixa etária. O sexo feminino, por outro lado, também parece apresentar maior risco de lesão renal, principalmente à nefrotoxicidade associada à TARV.
Os medicamentos antirretrovirais apresentam diferenças no perfil de segurança renal, embora a maior parte deles já tenha sido associada a algum grau de nefrotoxicidade
Nefrotoxicidade dos antirretrovirais
Está claro que os medicamentos antirretrovirais apresentam diferenças no perfil de segurança renal, embora a maior parte deles já tenha sido associada a algum grau de nefrotoxicidade. Dentro da classe dos inibidores da transcriptase reversa análogos de nucleosídios (ITRN), o tenofovir (TDF) é o mais frequentemente associado a esse tipo de efeito adverso. Originalmente, devido à semelhança com o adefovir (ADF) e aos relatos dos estudos pré-clínicos, a principal preocupação parecia ser a associação com a síndrome de Fanconi, doença tubular caracterizada por fosfatúria, aminoacidúria, uricosúria e glicosúria não associada à hiperglicemia.11
Os primeiros estudos clínicos mostraram uma baixa incidência de nefrotoxicidade significativa; isso, no entanto, pode ser atribuído ao seguimento reduzido de alguns deles, e ao perfil de pacientes e de esquemas antirretrovirais utilizados em outros. O estudo 903, por exemplo, principal estudo de fase 3 responsável pelo registro da droga como integrante de esquemas de primeira linha, incluiu pacientes infectados pelo HIV virgens de tratamento, sem patologias de base significativas ou doença renal estabelecida.12 Além disso, o esquema proposto para os pacientes desse estudo incluía a lamivudina (3TC), droga praticamente desprovida de toxicidade renal, e o efavirenz (EFV).
Estudos posteriores mostraram que a nefrotoxicidade do TDF é bem mais aparente em pacientes idosos, debilitados, de baixo peso, com hipertensão ou distúrbios metabólicos de difícil controle ou em uso de outras medicações nefrotóxicas.13 Outro dado observado foi que a associação do TDF em esquema utilizando inibidores de protease reforçados com ritonavir (IP/r) parece potencializar esse efeito tóxico, provavelmente pelo aumento na concentração tubular da droga por competição por sítios de excreção. Um estudo de coorte identificou que a administração conjunta de TDF com IP estava associada a uma redução significativa do clearence de creatinina em relação aos esquemas contendo inibidores da transcriptase reversa não análogos de nucleosídios (ITRNN), como o EFV.14
Por outro lado, o uso de IP/r com outras bases de ITRN parece ser mais seguro em relação ao perfil de nefrotoxicidade. Uma análise do estudo 5202, que comparou atazanavir/ritonavir (ATV/r) com EFV em uso conjunto com as combinações abacavir (ABC)/3TC ou TDF/emtricitabina (FTC), mostrou uma elevação no clearence de creatinina após o início da TARC com qualquer esquema, incluindo ATV/r com ABC/3TC, provavelmente pela melhora da lesão renal associada ao vírus, exceto a combinação TDF/FTC com ATV/r; nesse grupo, o clearence de creatinina permaneceu inalterado, e essa diferença foi considerada estatisticamente significativa.15
Uma análise da coorte EuroSIDA, publicada em 2010, avaliou a incidência da redução do clearence de creatinina para níveis abaixo de 60 mL/min na população de pacientes utilizando TARV em acompanhamento regular, nos quais havia registro disponível de mais de duas aferições de creatinina sérica no intervalo mínimo de três meses. Foi possível perceber um sinal referente à utilização de TDF como fator de risco associado à nefropatia, e esse sinal era intensificado pelo uso combinado com IP/r, como o ATV/r ou o lopinavir (LPV)/r.16
Esses dois antirretrovirais, bem como o indinavir (IDV), que não é mais usado em nosso meio, foram também independentemente associados ao desfecho do estudo. O uso limitado do FosAmprenavir/r (FAP/r) nessa coorte pode ter impedido a observação da relação desse IP com a doença renal.
Posteriormente, estudo prospectivo utilizando a base de dados do D:A:D partindo de pacientes com níveis basais de clearence de creatinina > 90 mL/min também encontrou associação do uso de LPV/r, ATV/r e TDF com o desenvolvimento de doença renal crônica (DRC), confirmadamente definida como ClCr (> 3 meses de intervalo) < 60 mL/min.17 Nessa população, com mediana de idade de 39 anos e mediana de contagem de células CD4 > 400 cópias/mL, apenas 1% dos paciente apresentou desfecho de DRC em um tempo de seguimento com mediana > 7 anos. Mesmo assim, foi possível identificar um aumento significativo no risco de apresentar tal desfecho por cada ano adicional de uso desses medicamentos. Nenhuma associação foi encontrada em relação ao ABC ou ao darunavir (DRV)/r, embora o número menor de pacientes expostos a esse medicamento até o momento possa limitar a sensibilidade para detectar sinais menos significativos.
Outra contribuição do D:A:D foi a elaboração de um escore preditivo de disfunção renal partindo dos fatores de risco encontrados nos estudos longitudinais da própria coorte: idade avançada, uso de drogas injetáveis, sexo feminino, coinfecção por HCV, valores basais reduzidos de clearence de creatinina, diabetes, hipertensão arterial e risco cardiovascular e contagem de células CD4.18 A partir da pontuação encontrada utilizando-se esses parâmetros, foi possível identificar uma população de baixo risco, em que a chance de desenvolver DRC foi de 1/393, uma de médio risco (1/47) e até uma população de alto risco, na qual as chances subiam de modo expressivo para 1/6. Esses resultados foram validados em outras duas coortes que, embora com menor número de participantes (gerando intervalos de confiança maiores), encontraram resultados semelhantes. Uma potencial aplicação prática desse escore seria identificar uma população com menor risco de lesão renal, na qual mesmo drogas com maior potencial de nefrotoxicidade, como o TDF e o ATV/r, possam ser utilizadas em áreas em que a monitoração laboratorial não seja amplamente disponível. Mais recentemente, uma coorte francesa demonstrou, utilizando o mesmo escore do D:A:D, que na população de baixo risco a utilização de TDF ou ATV/r não tem impacto no risco de nefropatia grave.
Um fator de confusão é o efeito que algumas medicações podem ter na creatinina sérica sem, no entanto, alterar significativamente a taxa de filtração glomerular (TFG). Embora a dosagem da creatinina seja utilizada habitualmente para estudo da função glomerular, algumas situações podem alterar especificamente a excreção da creatinina sem impactar os outros aspectos da função renal. Isso acontece, por exemplo, com a utilização do dolutegravir (DTG), inibidor de integrase (INI) já aprovado para uso em nosso país, no momento em fase de incorporação no arsenal de tratamento do protocolo clínico de diretrizes terapêuticas do Brasil. Esse medicamento está associado a um aumento da creatinina devido a uma competição específica pelo sítio de excreção tubular, um fenômeno análogo ao que ocorre com outras drogas, como a rilpivirina (RPV), a cimetidina (CMT) ou ao trimetoprima (TMP). Essa alteração, no entanto, é pouco expressiva – uma elevação em até 0,12 na creatinina sérica –, acontece no primeiro mês com estabilização nos meses subsequentes e não é acompanhada por nenhum outro parâmetro associado à lesão renal, como a proteinúria.19 Além disso, a avaliação da TFG por métodos alternativos, como a dosagem da cistatina C, uma proteína da família da cisteína protease, não revelou alterações dessas taxas. No entanto, como a creatinina sérica é o principal parâmetro de monitoração da função renal utilizado em nossa prática clínica, é importante efetuar essa pequena correção para que o cálculo seja mais fidedigno. Deve-se ressaltar que, nos estudos de desenvolvimento desse medicamento envolvendo pacientes virgens de TARV, nenhuma anormalidade grau 3 ou grau 4 foi detectada. Mais importante ainda, nenhum paciente interrompeu o uso de DTG devido à lesão renal. De fato, os INIs, como classe, parecem ser uma importante opção para pacientes com nefropatia.
O uso limitado do FosAmprenavir/r nessa coorte pode ter impedido a observação da relação desse IP com a doença renal
Outro medicamento que produz uma ação semelhante sobre os níveis séricos de creatinina é o cobicistat (COBI), droga sem efeito antirretroviral direto que funciona como reforço farmacológico, inibindo a metabolização de drogas pelo complexo do citocromo P450, tornando os níveis séricos dos fármacos mais confiáveis de maneira análoga àquela obtida com o ritonavir. A primeira formulação da droga aprovada para uso em alguns países do mundo (ainda não aprovado no Brasil) é a combinação em um mesmo comprimido com a base de ITRN TDF/FTC e o novo INI, elvitegravir (EVG). Porém, novas combinações, em especial aquela com o INI DRV, vêm surgindo no cenário com grande potencial para utilização em esquemas a partir da primeira linha, o que aumenta a importância de se conhecer a relação entre o uso dessas drogas e a monitoração da função renal.
Avaliação inicial
Todo paciente com infecção pelo HIV deve passar por uma avaliação inicial, que envolve a investigação quanto à presença de doença renal. A existência de fatores de risco deve ser pesquisada por meio da história clínica de nefropatias primárias, coinfecção por HCV e HBV e outras doenças que têm o rim como órgão-alvo, tais como hipertensão arterial e diabetes. A utilização de medicamentos potencialmente nefrotóxicos também deve ser registrada. Alguns pacientes são diagnosticados como portadores de HIV quando apresentam condições oportunistas cujo tratamento exige medicações nefrotóxicas, como amicacina e sulfametoxazol trimeto-prim, e até mesmo drogas que levam a um declínio previsível da função renal, como a anfotericina B. Mais frequentemente, os pacientes podem fazer uso regular de anti--inflamatórios não esteroides, que em geral não são percebidos como medicações perigosas, mas frequentemente se associam à lesão renal.
A avaliação laboratorial da função renal baseada na dosagem sérica de creatinina costuma levar a erros de julgamento. O mesmo valor de creatinina pode indicar uma função renal satisfatória em pacientes jovens e de maior massa muscular, e pode, por outro lado, ser um marcador de importante declínio em pacientes idosos de baixo peso. Por isso, é importante utilizar o valor da creatinina sérica em um modelo que permita calcular com mais acurácia o clearence de creatinina ou a TFG. As fórmulas mais utilizadas são as seguintes:
Modification of diet in renal disease (MDRD): Faz uma estimativa da TFG com base em idade, etnia, sexo e creatinina sérica. É a mais comumente utilizada para estimativa da TFG em laboratórios de análises clínicas, e é vista como o marcador mais fidedigno. Pode haver limitações em seu uso, no entanto, devido à dificuldade em definir a etnia em nosso meio.
Todo paciente com infecção pelo HIV deve passar por uma avaliação inicial, que envolve a investigação quanto à presença de doença renal
Cockcroft-Gault: Calcula o clearence de creatinina por uma fórmula que utiliza creatinina sérica, idade, peso e sexo. Durante muito tempo foi a mais popular, por ser a de cálculo mais simples. Além disso, é a fórmula recomendada para ajuste de doses para a maior parte dos produtos desenvolvidos pela indústria farmacêutica.
Chronic Kidney Disease Epidemiology Consortium (CKD-EPI): É calculada com base em idade, etnia e creatinina sérica. Esta equação começa a substituir a MDRD como estimativa da TFG em alguns países. Seu grande mérito é ter sido validada para pacientes com TFG > 60 mL/min.
Essas fórmulas estão apresentadas na tabela 1. Embora qualquer uma delas possa ser utilizada para estimar a TFG, é importante ressaltar que apenas a CKD-EPI foi validada em pacientes com clearence de creatinina > 60 mL/min, faixa em que ocorrem as primeiras alterações que indicam a doença renal.
A outra maneira de estimar o clearence de creatinina é por meio da avaliação da urina de 24 horas
A outra maneira de estimar o clearence de creatinina é por meio da avaliação da urina de 24 horas. Esse método, no entanto, apresenta importante limitação associada à perda de material no período. Mesmo em pacientes internados é comum haver erros relacionados a amostras desprezadas pelo paciente ou até pela equipe de saúde. Pode, no entanto, ainda ser útil em situações extremas, em que o cálculo utilizando o peso corporal não seja fidedigno, mesmo se utilizada apenas a massa magra, como em pacientes fisiculturistas ou amputados.
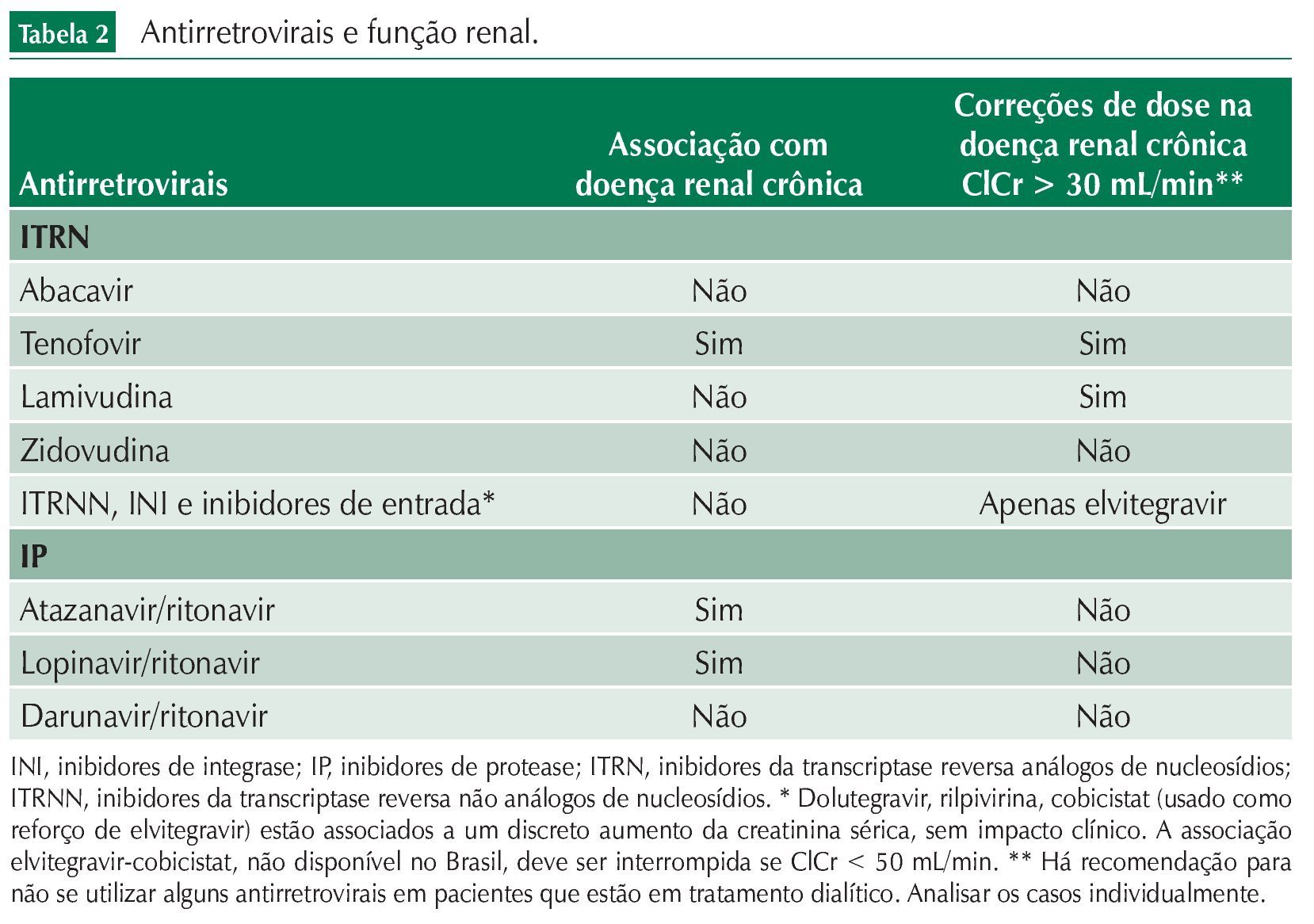
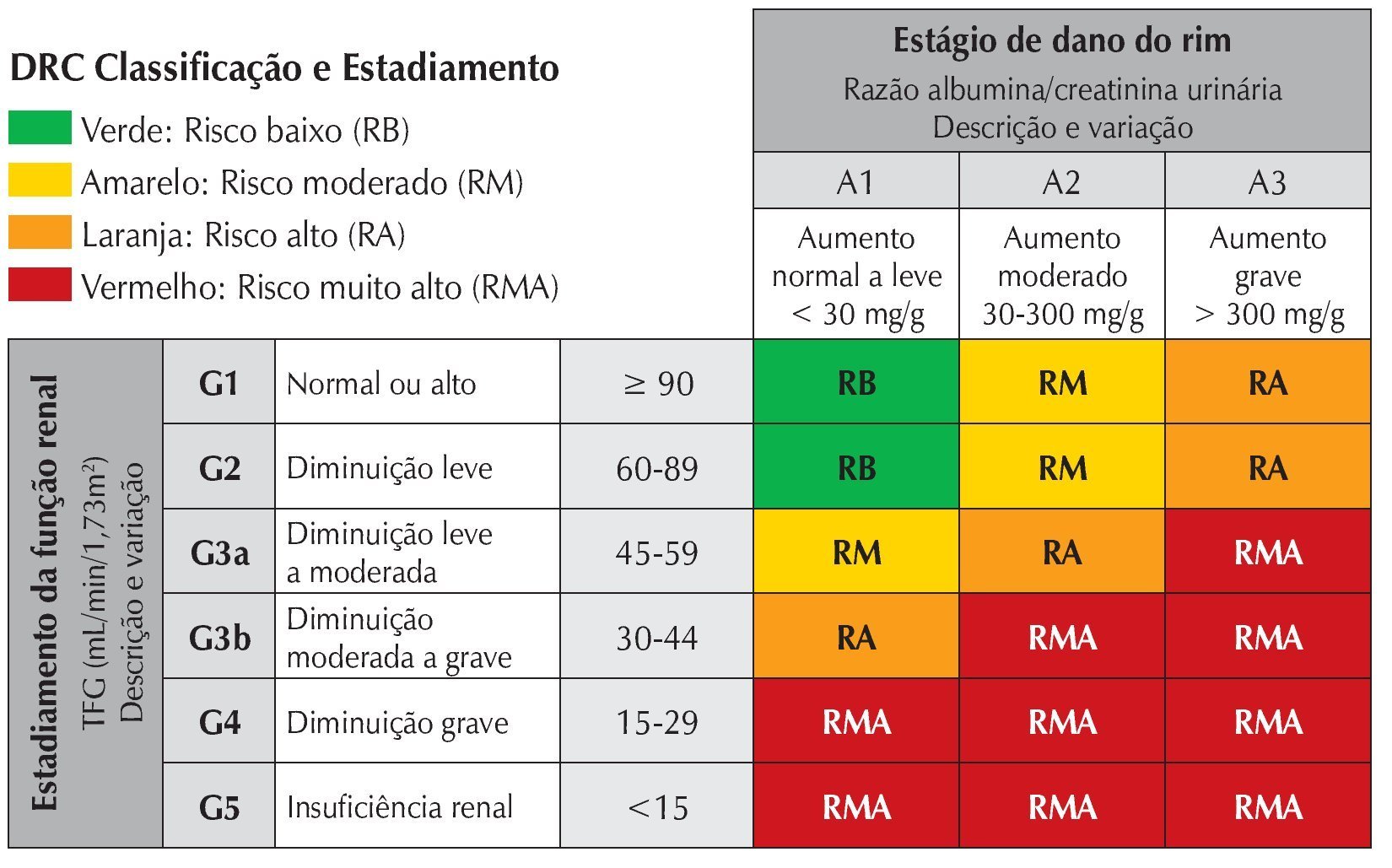
Outro instrumento diagnóstico de rastreamento muito importante é o exame de urina tipo 1 ou elementos anormais no sedimento (EAS). Esse exame nos permite identificar alterações glomerulares ou tubulares de pacientes que ainda mantêm a TFG em níveis satisfatórios. Este é, portanto, o marcador isolado mais sensível de doença renal e já foi demonstrado que pacientes com proteinúria significativa e TFG preservada podem ter pior prognóstico em relação a pacientes sem proteinúria e TFG moderadamente comprometida. Essa importância está refletida na mudança do modelo de estadiamento da lesão renal, no qual a presença de proteinúria passou a ter um peso específico (fig. 1). Além disso, a ausência de proteinúria afasta a hipótese de doença glomerular. Qualquer paciente que apresente valor de proteinúria quantificada como maior ou igual a 1+ deve ser avaliado mais cuidadosamente com exames adicionais.
Figura 1 Classificação da doença renal crônica.
Assim como a avaliação do clearence de creatinina, a avaliação da proteinúria não deve ser realizada rotineiramente pela coleta de urina em 24 horas, em razão dos constantes problemas associados à perda na coleta. A utilização da taxa da dosagem de proteína sobre a dosagem de creatinina (P/C) na amostra única permite a correção para fatores como a excessiva diluição da urina, o que poderia subestimar a magnitude da proteinúria. Esse método tem uma correlação confiável com os níveis presumidos de excreção renal de proteína.
A 3TC, assim como a FTC (não disponível em nosso país), é reconhecida como uma droga com excelente perfil de segurança, inclusive em relação à nefrotoxicidade
Terapia antirretroviral na doença renal crônica
As diretrizes brasileiras para TARV no Brasil, assim como todos os principais documentos internacionais, indicam o início da terapia para qualquer paciente, independentemente da presença de sintomas ou da contagem de células CD4. Todos os esquemas recomendados para terapia de primeira linha envolvem uma base de ITRN, além da presença de uma terceira droga de outra classe, seja ITRNN, IP/r ou, em países onde o preço desses agentes não limita a escolha, INIs.
A base de ITRN mais frequentemente recomendada para uso no Brasil é a combinação de TDF com 3TC, presente em formulações combinadas que também podem incluir o EFV, um ITRNN ainda hoje considerado agente preferencial para uso como terceira droga em nosso meio. A 3TC, assim como a FTC (não disponível em nosso país), é reconhecida como uma droga com excelente perfil de segurança, inclusive em relação à nefrotoxicidade. Há recomendação do fabricante para ajuste de dose da 3TC na insuficiência renal a partir de clearence de creatinina < 50 mL/min, embora a droga tenha um índice terapêutico elevado e não haja relatos frequentes de paraefeitos nesse contexto.
Por outro lado, a presença de disfunção renal na avaliação inicial ou um grande número de fatores de risco para DRC podem limitar o uso de TDF. As alternativas, no entanto, não são amplas. A zidovudina (AZT) muitas vezes pode ser prejudicial devido à presença de anemia; além disso, apresenta perfil de toxicidade metabólica em longo prazo considerado inaceitável por muitos médicos, principalmente devido à associação com fenômenos de distribuição de gordura corporal (lipodistrofia). A didanosina apresenta também perfil de segurança desfavorável em pacientes com insuficiência renal, e é difícil a correção da dose devido à indisponibilidade de formulações variadas. O ABC é tradicionalmente visto como droga de escolha para combinação com a 3TC nesse contexto, não necessitando de ajuste. Essa droga, porém, está associada a um risco de reação de hipersensibilidade potencialmente grave em cerca de 5% dos pacientes. O teste genotípico para detecção do HLA 5701, que pode ajudar a prever os pacientes em risco para esse evento, não está disponível em nosso meio.
A grande expectativa em relação à nefrotoxidade dos antirretrovirais está relacionada ao desenvolvimento e à liberação recente para uso em alguns países de uma nova formulação do TDF, conhecida como tenofovir alafenamida
Em relação a outras classes, os ITRNN utilizados clinicamente não precisam de ajuste de dose. É preciso lembrar que a RPV, não disponível em nosso meio, também pode estar associada a uma discreta elevação da creatinina, clinicamente irrelevante. De modo geral, o perfil de segurança renal dessa classe é considerado satisfatório.
Em relação aos IP/r, embora sejam metabolizados predominantemente por via hepática, a escolha deve ser individualizada em relação ao risco de toxicidade renal, conforme indicado anteriormente. Assim, o LPV/r e principalmente o ATV/r devem ser evitados nos pacientes com alterações identificadas na função renal ou com múltiplos fatores de risco para DRC.
Os INIs, por sua vez, parecem medicações seguras do ponto de vista de nefrotoxicidade, ressaltando-se o efeito específico na creatinina sérica do DTG e do COBI, que não estão associados à doença renal progressiva. Essa classe pode, portanto, ser utilizada como alternativa a agentes de um esquema terapêutico em uso que apresente risco de disfunção renal progressiva tanto em relação ao TDF quanto aos IPs reforçados com ritonavir, nesse caso levando-se em conta o risco em pacientes previamente falhados a outros esquemas caso o agente escolhido seja o raltegravir (RAL), que apresenta menor barreira genética. Por ser coformulado com o TDF, o EVG não deve ser iniciado em pacientes com doença renal crônica.
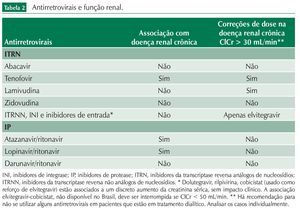
A relação entre os antirretrovirais e a função renal está resumida na tabela 2.
Perspectivas
Por tudo o que foi aqui exposto, compreende-se que a grande expectativa em relação à nefrotoxidade dos antirretrovirais, no momento, está relacionada ao desenvolvimento e à liberação recente para uso em alguns países de uma nova formulação do TDF, conhecida como tenofovir alafenamida (TAF). Trata-se de uma pró-droga que limita a exposição sistêmica do TDF, uma vez que a transformação da pró-droga nesse composto se dá principalmente nas células mononucleares de defesa, aumentando sua concentração especificamente nos sítios em que ela deve exercer sua ação terapêutica, mantendo concentrações plasmáticas em níveis reduzidos.20
Esse novo produto foi desenvolvido em diversas formulações de doses fixas combinadas envolvendo FTC isoladamente, bem como FTC e RPV e FTC, COBI e EVG. Os dados mais consistentes vêm desta última combinação, que foi utilizada em estudos controlados, em comparação com a mesma combinação envolvendo a formulação tradicional de tenofovir disoproxil fumarato – TDF. Os primeiros dados até a semana 48 já mostravam um menor aumento na creatinina sérica com o uso do TAF (0,08 × 0,12; p < 0,001), sugerindo também um melhor perfil de segurança renal por taxas de proteinúria significativamente menores.21 Mais recentemente, dados de seguimento até a semana 144 comprovaram um menor risco de progressão para DRC no grupo que utilizou TAF não só em relação à população caracterizada como de menor risco segundo o escore do D:A:D, mas também em relação à de maior risco. A troca estável de TDF para TAF também parece estar associada com melhora em relação aos marcadores de lesão renal.
A doença renal é um evento clínico de grande importância na população de pacientes infectados pelo HIV
Conclusões
A doença renal é um evento clínico de grande importância na população de pacientes infectados pelo HIV, em decorrência da ação direta do vírus nos glomérulos e túbulos renais, comorbidades prevalentes nesse grupo, e à nefrotoxicidade dos medicamentos antirretrovirais. É importante que os clínicos envolvidos no cuidado aos pacientes HIV+ estejam preparados para identificar essa condição, identificando os fatores de risco reconhecidamente envolvidos, utilizando adequadamente as ferramentas disponíveis e orientando os pacientes sobre a importância dessa monitoração. É importante também conhecer cada vez mais o perfil de segurança renal dos medicamentos utilizados na TARC, uma vez que esse tipo de paraefeito pode demorar muitos anos até ser clinicamente reconhecido. Em especial, o papel do TDF deve ser destacado, por ser o agente ITRN de escolha em esquemas de primeira linha e estar associado significativamente à doença renal, pelo menos até que a nova formulação em estudo, o TAF, comprove seu melhor perfil de segurança associado a menor exposição sistêmica na prática clínica. A perspectiva de poder contar com INIs como agentes alternativos de primeira linha e a maior disponibilização do DRV/r também podem ter impacto significativo, limitando a exposição a drogas há mais tempo em uso no nosso meio e que apresentam perfil de segurança renal insatisfatório.