Diversos estudos demonstraram que o uso de antirretrovirais por via oral, antes ou após exposição sexual, é capaz de evitar a transmissão do HIV. Há estudos que sugerem que o uso tópico de antirretrovirais também pode ser eficaz. 1-4 Este artigo, no entanto, se restringirá ao uso de antirretrovirais por via oral. É importante ressaltar, ainda, que as profilaxias pré-exposição (PrEP) e pós-exposição (PEP) não substituem as demais medidas para a prevenção da infecção pelo HIV.
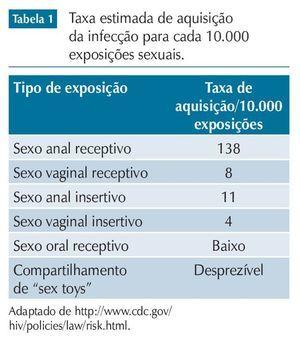
A infecção pelo HIV não é uma consequência inevitável da exposição ao vírus. A tabela 1 apresenta a taxa estimada de aquisição da infecção para cada 10.000 exposições sexuais. O risco de transmissão é maior em presença de outras infecções sexualmente transmissíveis, infecção aguda ou muito avançada pelo HIV e carga viral plasmática elevada. Por outro lado, o risco é menor quando é usado preservativo ou quando o ato sexual envolve indivíduo circuncidado. Na tabela, nenhum desses fatores é levado em consideração. Cumpre ressaltar, também, não haver caso relatado de transmissão sexual a partir de indivíduo com carga viral plasmática comprovadamente indetectável há pelo menos seis meses.
Profilaxia pós-exposição sexual
Um estudo caso-controle realizado no começo da década de 1990 indicou haver uma redução de aproximadamente 80% no risco de aquisição da infecção por HIV por parte de profissionais de saúde que haviam sofrido acidentes perfurocortantes e que haviam feito uso de zidovudina para PEP. Embora não existam ensaios clínicos randomizados para confirmar essa observação, sua plausibilidade biológica e os resultados de estudos usando modelos animais fizeram com que a PEP, inicialmente para acidentes perfurocortantes envolvendo profissionais de saúde, posteriormente para outros tipos de exposição, incluindo sexual, passasse a fazer parte das medidas de saúde pública rotineiramente recomendadas para a prevenção da infecção pelo HIV. Estudos prospectivos (o primeiro a ser publicado tendo sido realizado no Brasil)5 confirmaram que o uso de PEP iniciada até 72 horas após a exposição e mantida por 28 dias é capaz de reduzir o risco de aquisição da infecção pelo HIV após exposições sexuais.
Na literatura há relato de 49 soroconversões entre homossexuais masculinos que fizeram uso de PEP.5-9 Há um relato de caso na Itália, no qual o indivíduo também foi infectado com o vírus da hepatite C, e 48 soroconversões em seis estudos prospectivos entre 1.535 participantes que relataram ter feito uso de PEP.5-9 Pelo menos 40 desses provavelmente resultaram de comportamentos de risco após terem completado PEP; 35 dessas soroconversões restantes ocorreram mais de 180 dias após o fim de PEP e, portanto, dificilmente representam falha. As oito soroconversões restantes podem ser classificadas como potenciais falhas de PEP. Genotipagem realizada no último dia de PEP do caso de possível falha ocorrido no Brasil apresentava a mutação M184V, que confere resistência à lamivudina (3TC). O esquema utilizado, recomendado à época, foi a combinação de zidovudina (AZT) com 3TC.5 Outras quatro soroconversões ocorreram em 91, 133, 160 e 168 dias após o início de PEP, incluindo três que afirmaram terem completado os 28 dias de tratamento. Quanto às demais três possíveis falhas de PEP, não foram publicados os esquemas utilizados, a adesão ao tratamento, o tempo entre exposição e início de PEP ou de ocorrência da soroconversão.
Nos casos em que ocorre infecção apesar do uso de PEP, é possível, ao menos em teoria, haver seleção de vírus resistentes. No entanto, dada a raridade de casos de falha relatados, a maioria sem que testes de resistência tenham sido realizados, a probabilidade de sua ocorrência é desconhecida. No caso de falha relatado no Brasil, o indivíduo apresentava vírus com mutação de resistência à 3TC (usada no esquema profilático) no 28o dia após a exposição. No entanto, não foi possível determinar se teria ocorrido seleção de vírus resistente ou infecção primária por vírus resistente.5
De acordo com as diretrizes brasileiras,10 a profilaxia pós-exposição sexual é recomendada nas seguintes situações:
• Parceiro sabidamente soropositivo, independentemente do tipo de exposição (anal ou vaginal). No entanto, é importante ressaltar que não há casos comprovados de transmissão da infecção por indivíduos em uso de antirretrovirais e com carga viral plasmática indetectável há pelo menos seis meses.
• Parceiro com sorologia desconhecida, mas com alta probabilidade de ser soropositivo, em situações de exposição anal receptiva.
Ainda de acordo com as diretrizes brasileiras, a profilaxia pós-exposição deverá ser considerada para as seguintes situações:
• Parceiro com sorologia desconhecida, mas com alto risco de estar infectado, no caso de exposição anal ou vaginal, insertiva ou receptiva.
• Parceiro com sorologia desconhecida e de população de baixa prevalência, em caso de exposição anal receptiva.
Em casos de violência sexual, a profilaxia deve ser recomendada nas primeiras 72 horas após a violência, quando houver penetração vaginal e/ou anal, mesmo que a condição sorológica do agressor seja desconhecida. Não está recomendado o uso de profilaxia para casos de penetração oral sem ejaculação, agressor sabidamente HIV negativo, violência sofrida há mais de 72 horas e abuso crônico pelo mesmo agressor.
Nos casos em que ocorre infecção apesar do uso de PEP, é possível, ao menos em teoria, haver seleção de vírus resistentes.
Todas as pessoas avaliadas para potencial uso de PEP devem receber orientação e são candidatas a tratamento para outras infecções sexualmente transmissíveis, incluindo infecções bacterianas e por clamídias e hepatites, além de gravidez, no caso de mulheres em idade fértil.
A maioria dos estudos publicados não demonstrou haver relação entre disponibilidade de PEP e aumento da frequência de comportamentos de risco. Por outro lado, esses mesmos estudos demonstraram que, em nível populacional, usuários de PEP tendem a relatar comportamentos continuados de risco com mais frequência, sendo, portanto, potenciais candidatos ao uso de profilaxia pré-exposição (PrEP),1 além de aconselhamento de outras intervenções comportamentais.11,12
A PEP é uma das raras situações em que o início da terapia antirretroviral é uma urgência médica. Assim, a PEP deve ser iniciada o mais precocemente possível, idealmente nas primeiras duas horas após a exposição e, no máximo, até 72 horas após a exposição.
As primeiras medidas a serem tomadas incluem a determinação do status sorológico da pessoa potencialmente exposta, da fonte (se disponível), o tipo de exposição, o tempo transcorrido desde a exposição e a frequência de exposição. Ademais, deve ser avaliada a probabilidade de transmissão de outras infecções sexualmente transmissíveis, incluindo hepatites B e C, gonorreia, sífilis e Chlamydia sp., além de gravidez, no caso das mulheres. A depender dos resultados desses testes, os mesmos devem ser repetidos após 4-6 semanas. Em caso de sorologia negativa para hepatite B, recomenda-se a vacinação.
A PEP está indicada apenas para pes soas soronegativas. Como pessoas potencialmente expostas podem estar infectadas, mas não saberem, uma avaliação sorológica é mandatória. Assim, antes de ser indicado o uso da PEP, deve ser realizado teste rápido. Caso não estejam disponíveis testes rápidos que utilizem sangue, testes com saliva podem ser usados. Em caso de suspeita de infecção recente pelo HIV, deve-se proceder à realização de teste de imunoenzimático de quarta geração (que inclui detecção de antígeno p24).
Se a fonte da possível infecção for conhecida e seus status sorológico for desconhecido, apenas anamnese cuidadosa poderá determinar a indicação de PEP. Caso não seja possível determinar o status sorológico da fonte, a PEP deve ser instituída enquanto são aguardados os resultados dos testes, podendo ser interrompida se a infecção pelo HIV for afastada. Caso a fonte seja sabidamente soropositiva, é essencial determinar sua carga viral plasmática. Caso seja detectável, a genotipagem pode ser útil para eventual adaptação do esquema recomendado.
No Brasil, o esquema preferencial para PEP é a coformulação tenofovir/lamivudina (TDF/3TC) em um único comprimido associada com atazanavir (ATV) 300 mg e ritonavir 100 mg, por 28 dias. Importante lembrar que é contraindicado a administração de ATV por pessoas que fazem uso de inibidores da bomba de prótons. Como alternativas ao ATV, o Ministério da Saúde recomenda o uso de lopinavir/ritonavir (LPV/r) ou de AZT. Em caso de exposição sexual a indivíduo sabidamente em uso de antirretrovirais e em falha virológica, um especialista deverá ser consultado.10
Dificuldades de adesão ao esquema prescrito são descritas em vários estudos, particularmente no caso de vítimas de violência sexual. O esquema preferencialmente prescrito no Brasil é geralmente bem-tolerado, sendo relativamente comuns queixas de enjoo nos primeiros dias.
A PEP é uma das raras situações em que o início da terapia antirretroviral é uma urgência médica.
Não é necessária monitoração laboratorial.
Em países sem restrições orçamentárias, os esquemas preferencialmente recomendados incluem a coformulação tenofovir/ emtricitabina (TDF/FTC) associada a um inibidor da integrase – raltegravir (RAL) ou dolutegravir (DTG).
Embora bemsucedida, a estratégia do estudo IPERGAY não é recomendada para uso rotineiro.
Profilaxia pré-exposição sexual
A PrEP é amplamente usada em medicina, envolvendo o uso de uma droga antes de haver exposição a algum agente infeccioso, de modo a evitar que ocorra infecção ou adoecimento (malária, por exemplo). No caso de HIV, consiste no uso de drogas antirretrovirais antes de uma possível ou provável exposição ao vírus, como no caso de conceptos de mulheres soropositivas ou indivíduos com comportamentos sexuais que os coloquem em risco de se infectarem. Há inúmeros estudos em andamento envolvendo vários modos de PrEP, incluindo uso tópico de gel e/ou anéis vaginais impregnados com microbicidas ou antirretrovirais, drogas de ação prolongada orais, injetáveis ou implantáveis.
No momento, apenas a coformulação TDF/FTC em um único comprimido se encontra aprovada para PrEP. Essas drogas foram inicialmente escolhidas para serem estudas para uso como PrEP por sua atividade antiviral, segurança, barreira genética e baixa frequência de eventos adversos. Em modelos animais, já foi demonstrada a superioridade da combinação quando comparada com TDF isoladamente. Por outro lado, em estudos clínicos com seres humanos, as diferenças de eficácia foram pequenas. Cumpre notar, porém, que o uso isolado de TDF não foi estudado em algumas populações-chave, como homossexuais masculinos.
Até o momento foram publicados os resultados de vários estudos prospectivos e randomizados envolvendo TDF, isolado ou em combinação com FTC, e cujo desfecho avaliado foi infecção pelo HIV. Desses estudos, participaram mais de 17.000 indivíduos.
O estudo IprEX, do qual participaram centros brasileiros, foi o primeiro estudo controlado e randomizado a demonstrar a eficácia de PrEP para a redução do risco de aquisição da infecção por HIV em homossexuais masculinos e pessoas transgênero.1 Esses resultados foram posteriormente confirmados pelos estudos IPERGAY e PROUD.13,14 De maneira diferente dos estudos IprEX e PROUD, que envolveram o uso diário e continuado de TDF/FTC, o estudo IPERGAY (realizado na França e no Canadá) envolveu uma estratégia “on demand”, na qual era recomendado tomar apenas quatro comprimidos (dois comprimidos, duas a 24 horas antes de uma potencial relação sexual de risco, seguidos de um comprimido 24 horas e outro 48 horas depois da primeira dose). Embora bem-sucedida, a estratégia do estudo IPERGAY não é recomendada para uso rotineiro, tendo em vista haver dúvidas teóricas quanto à sua eficácia em populações com frequência menor de exposições de risco.
Os estudos Partners PrEP e TDF2 foram conduzidos na África e demonstraram altos níveis de proteção com o uso de doses diárias de TDF ou de TDF/FTC em homens e mulheres heterossexuais, incluindo aqueles em parcerias estáveis sorodiscordantes.2,3
Na Tailândia, foi realizado um estudo utilizando apenas TDF e do qual participaram usuários de drogas injetáveis. Nos participantes em que foi possível demonstrar a presença de TDF em amostras de sangue, a proteção estimada foi de 74%.15
Em dois estudos envolvendo mulheres heterossexuais na África, a PrEP não teve qualquer eficácia em prevenir a infecção pelo HIV.16,17 Estudos posteriores envolvendo dosagem de nível sérico de amostras de sangue demonstraram baixíssima adesão às medicações.
Esses estudos, em particular após as análises de níveis séricos de TDF e/ou de FTC, demonstraram conclusivamente haver relação direta entre adesão à medicação e eficácia. Assim, indivíduos com níveis séricos compatíveis com mais de quatro tomadas semanais obtiveram proteção estimada superior a 99%.1
Eventos adversos sérios são extremamente raros. Discreto enjoo é relativamente comum nas primeiras semanas, desaparecendo rapidamente. Alterações significativas de função renal são incomuns, havendo rápida normalização após a interrupção da medicação.18,19
No Brasil, espera-se que a PrEP esteja disponível na rede pública a partir de 1º de dezembro de 2016. A PrEP deverá ser recomendada para pessoas sob alto risco de aquisição da infecção pelo HIV, incluindo homossexuais masculinos, pessoas trans, profissionais do sexo, pessoas que usam drogas e indivíduos em parcerias sorodiscordantes (se o indivíduo não estiver em uso de antirretrovirais e com carga viral indetectável por, pelo menos, seis meses).
Antes do início da PrEP deve ser excluída infecção pelo HIV, respeitando-se o fluxograma de testagem determinado pelo Ministério da Saúde. Caso haja suspeita clínica ou epidemiológica de infecção aguda pelo HIV apesar de sorologia negativa, o início da PrEP deverá ser postergado até que a infecção seja afastada por meio de testes moleculares. Deve, também, ser avaliada a presença de outras infecções sexualmente transmissíveis, em particular hepatites B e C. Indivíduos sem evidência sorológica de infecção prévia pelo vírus da hepatite B devem ser vacinados. A presença de infecção por hepatite B não é contraindicação à PrEP. Embora haja o risco teórico de reativação de hepatite B em indivíduos HBsAg positivos, anti-HBs negativos quando da interrupção de TDF/ FTC, nenhum caso foi até hoje relatado.
No Brasil, esperase que a PrEP esteja disponível na rede pública a partir de 1º de dezembro de 2016.
A função renal deve ser avaliada antes do início da PrEP. A PrEP não deve ser prescrita para indivíduos com comprometimento da função renal, expresso por clearance de creatinina inferior a 70 mL/min (60 mL/min segundo algumas recomendações). Avaliação do clearance de creatinina deverá ser repetida após um e após quatro meses do início da PrEP. Se não houver alteração, poderá ser reavaliada a cada 6-12 meses. Em caso de queda significativa (< 70 mL/min), a PrEP deverá ser interrompida até a normalização da função renal, quando poderá ser reinstituída sob observação mais cuidadosa. Após o início da PreP, é comum haver diminuição e posterior estabilização da densidade óssea, não tendo sido descrito aumento do risco de fraturas espontâneas.20
Conforme mencionado antes, apenas a coformulação TDF/FTC se encontra aprovada para PrEP. A indicação, no Brasil, deverá ser para uso diário.
Deverão ser feitas reavaliações em um e três meses após o início da PrEP. A partir da segunda reavaliação, as mesmas poderão ser trimestrais. De cada reavaliação deverá constar sorologia para HIV e pesquisa de outras infecções sexualmente transmissíveis, conforme indicação clínica ou epidemiológica. Sorologias para sífilis e hepatite C deverão ser repetidas anualmente.