Introdução
Um divisor de águas: o estudo SMART
Após a introdução da terapia antirretroviral (TARV) combinada de alta potência, observamos uma mudança progressiva nos desfechos clínicos de pacientes infectados pelo HIV-1. Se, inicialmente, as principais causas de morbimortalidade eram basicamente problemas relacionados a infecções, esse panorama começou a mudar à medida que a supressão virológica estável passou a ser mais frequente. Nesse contexto, observamos a elevação progressiva das causas não infecciosas como principais problemas de saúde nessa população.1-3
Na atualidade, problemas como doenças metabólicas, cardiovasculares e neoplásicas passaram a liderar as causas de morte em pacientes com HIV-AIDS.4
Some-se a esses fatos o progressivo envelhecimento dessa população, secundário tanto à maior sobrevida propiciada pelos avanços na terapia quanto à aquisição da infecção por pessoas mais velhas, e teremos um cenário nosológico completamente modificado quando comparado ao observado nos primórdios da pandemia de AIDS.
Nesse contexto, vários estudos buscaram entender as razões para essas mudanças, tentando esclarecer os principais fatores responsáveis por esse novo cenário epidemiológico. Nas páginas seguintes tentaremos resumir as principais evidências disponíveis a esse respeito.
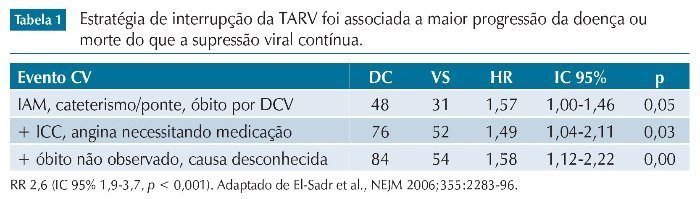
Após a introdução da TARV combinada de alta potência, tornou-se claro que a erradicação do HIV não era possível com a tecnologia disponível, e o surgimento de problemas metabólicos secundários ao uso das drogas antirretrovirais levantou preocupações sobre os efeitos do uso crônico desses medicamentos, já que a impossibilidade de cura da infecção exigia uso ininterrupto dessas drogas para garantia da supressão viral. O estudo SMART buscou avaliar se a interrupção temporária do tratamento, em pacientes estáveis, com supressão virológica e contagem de células CD4 superior a 500/mm3, era capaz de reduzir a incidência de efeitos colaterais para pacientes em tratamento.5
O estudo foi interrompido antes de sua conclusão devido às conclusões de uma análise interina de segurança, que revelou uma elevação da mortalidade por qualquer causa em pacientes que inter-rompiam a terapia, quando comparados aos que mantinham supressão virológica. A tabela 1 resume esses achados.
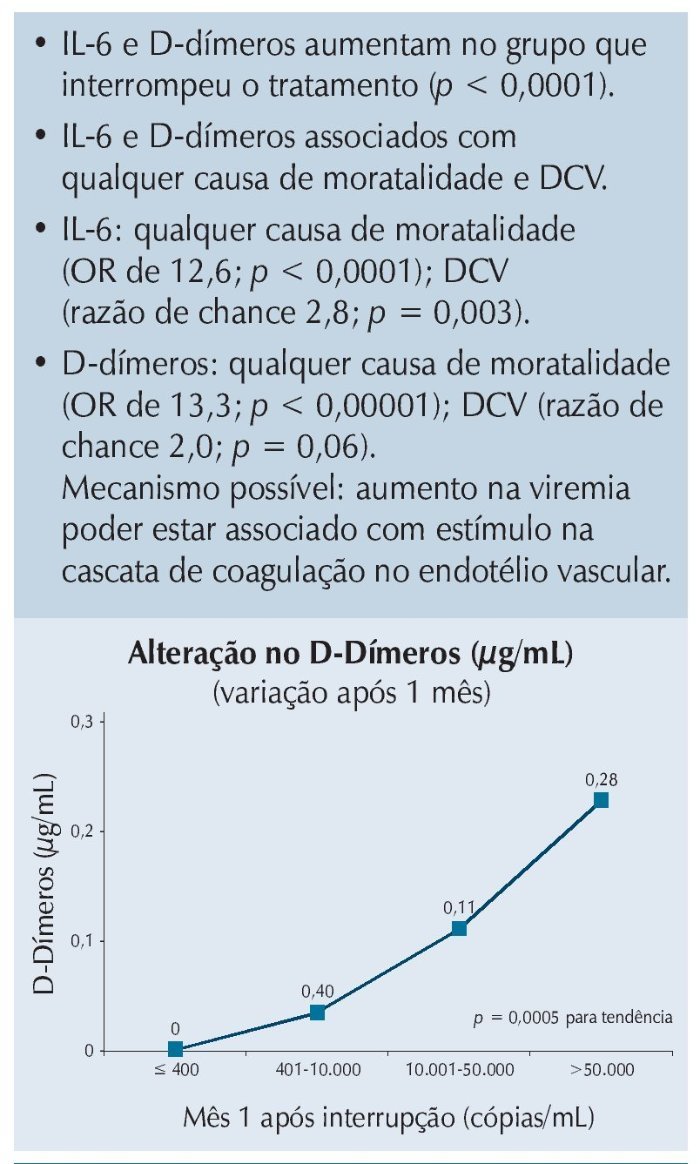
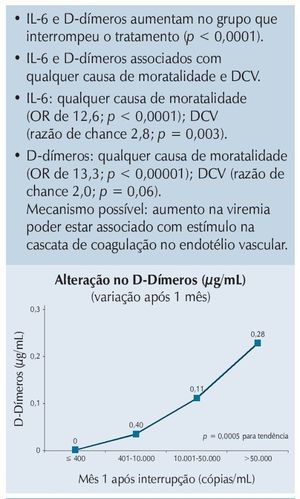
Quando avaliadas as razões para essas alterações, ficou claro que elevações nos níveis de algumas citocinas (especialmente IL-6) e de D-Dímeros eram os principais responsáveis pelos problemas detectados, e que essas alterações provavelmente eram secundárias à replicação viral persistente em pacientes sem TARV, levando a danos do endotélio vascular, como resumido na figura 1.
Figura 1 Estudo SMART: interrupção do tratamento associada com aumento nos D-dímeros e IL-6.l.
Vários estudos têm associado inflamação persistente em pacientes infectados pelo HIV-1 a fatores como ativação imune, secundária a várias causas.
Ativação imune persistente e inflamação
Vários estudos têm associado inflamação persistente em pacientes infectados pelo
HIV-1 a fatores como ativação imune, secundária a várias causas. Dentre eles, citamos a replicação viral persistente, mesmo de baixa magnitude, coinfecções e translocação microbiana. Em pacientes sem TARV, observa-se uma rápida proliferação de células T CD38+HLA-DR+, fenótipo claramente associado à ativação imune dessas subpopulações celulares.7 Em outro estudo, Hunt observou que a intensidade da ativação de células T CD8+ após seis meses de TARV predizia de modo consistente a mortalidade de pacientes Ugandenses.8 As razões potencialmente envolvidas na ativação imune persistente parecem derivar de várias condições, como:
• Replicação residual do HIV;
• CMV (e outras coinfecções prevalentes);
• Translocação microbiana;
• Ausência de respsota imunorregulatória;
• Disfunção tímica e defeitos residuais na resposta imune adaptativa;
• Fibrose linfoide;
• Comorbidades (síndrome metabólica, adiposidade central).
Tentativas de intensificação da TARV com raltegravir, com o objetivo de reduzir os marcadores de ativação imune por meio da supressão da replicação viral residual, apresentaram resultados contrastantes, com um deles sugerindo que a replicação viral de baixa intensidade não era relacionada à ativação imune persistente, enquanto o segundo mostrava impacto da intensificação com raltegravir, com redução da replicação viral e dos níveis dos marcadores de ativação imune.8,9
A maioria dos estudos, por outro lado, implica a translocação bacteriana como um dos fatores responsáveis pela ativação imune persistente. Brenchley, em 2006, demonstrou que os níveis de lipopolissacárides bacterianos (LPS) eram significativamente aumentados em pacientes sem TARV, comparados aos com supressão virológica.10 Mesmo pacientes com supressão viral apresentavam níveis de LPS significativamente maiores que controles soronegativos. O maior nível sérico de LPS seria decorrente do dano à mucosa intestinal causado pelo HIV, com subsequente translocação bacteriana e inflamação. Mais recentemente, outro estudo mostrou que os níveis de sCD14 (marcador de LPS e de ativação de monócitos e macrófagos) era preditor independente de mortalidade.11
Coinfecções crônicas, como por CMV, também se mostraram potentes indutores de ativação imune persistente. A resposta imune celular específica a esse vírus era cinco vezes mais intensa em pacientes infectados pelo HIV-1 com supressão viral, em comparação a controles soronegativos para o HIV.12
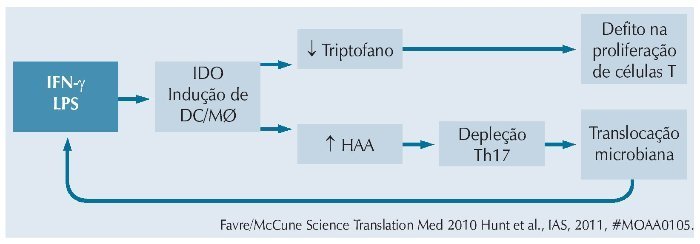
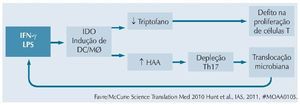
Por outro lado, a ativação imune persistente seria responsável por aumentar os níveis de indoleamine 2,3-dioxigenase (IDO), que por sua vez induziria ativação de células dendríticas e macrófagos, resultando em redução dos níveis de triptofano e elevação de seu catabólito, ácido 3-hidroxiantranílico (HAA). Essas mudanças causam depleção de células Th17, defeitos de proliferação de células T e mais translocação microbiana, que realimentaria o círculo vicioso.13,14 A figura 2 resume essa cadeia de eventos.
Figura 2 Inflamação aumenta produção de IDO, levando a depleção de Th17, translocação microbiana e mais inflamação.
Finalmente, a inibição da telomerase, enzima essencial para manutenção e restauração dos telômeros, pode ser inibida por infecção com algumas das drogas antirretrovirais, como os análogos timidínicos (zidovudina e estavudina) e o tenofovir, contribuindo para doenças não associadas ao HIV que acometem pacientes sob TARV estável.
Coagulação e eventos não relacionados à AIDS
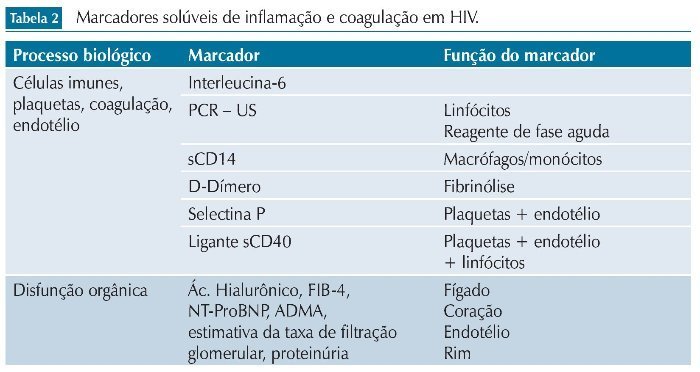
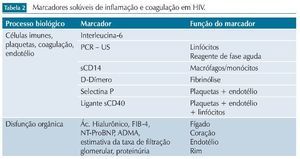
Vários biomarcadores têm sido propostos para avaliar a inflamação e sua relação com eventos não relacionados à AIDS em pacientes infectados pelo HIV-1. Dentre eles, destacamos alguns relacionados aos processos biológicos, como marcadores de ativação imune, de inflamação do endotélio vascular, plaquetas e da coagulação. A seguir, listamos alguns desses marcadores e suas principais características.
Coinfecções crônicas, como por CMV, também se mostraram potentes indutores de ativação imune persistente.
Estudos como ESPRIT e SMART (REF) demonstraram claramente a relação entre níveis elevados de D-Dímero e mortalidade. Pacientes com essas alterações apresentavam risco de mortalidade 4,5 (ESPRIT) a 6,0 (SMART) vezes maior que aqueles com níveis normais de D-Dímeros. Essas taxas permaneciam significativamente mais elevadas (risco de 2,3 e 2,6, respectivamente) quando consideradas apenas as mortes não relacionadas à AIDS. Além disso, observou-se que após o início da TARV (estudo SMART), ocorria uma redução importante dos níveis deste marcador, evidenciando de modo claro a relação entre viremia e alterações imunes, e a elevação de D-Dímeros.15
Alguns fatores foram significativamente associados a níveis elevados de D-Dímeros no estudo START, como idade, sexo e raça. Pacientes negros, com maior idade e de sexo feminino apresentavam maior elevação desse marcador. Além disso, menor CD4 e maior carga viral também foram positivamente associado à elevação de D-Dímeros, assim como maior nadir de CD4.16
Estudos como ESPRIT e SMART (REF) demonstraram claramente a relação entre níveis elevados de D-Dímero e mortalidade.
Neste estudo, a elevação nos níveis séricos de IL-6 e PCR-us também foram associados a maiores níveis de D-Dímeros nesse estudo. Não se observou associação entre o tipo de ARV utilizado e níveis de D-Dímeros. Outros fatores associados a essas alterações foram coinfecções por hepatites a vírus B ou C, níveis de fibrose hepática mais avançados e redução da taxa de filtração glomerular. No estudo SILCAAT, foi detectada uma associação significativa entre anemia e elevação de D-Dímeros.17
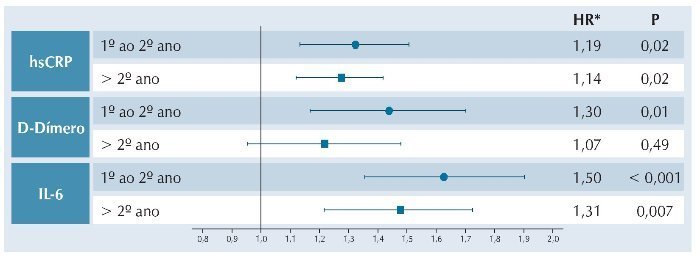
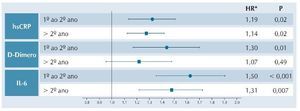
Em outro interessante artigo, Borges et al. mostraram uma associação significativa entre plaquetopenia e eventos associados ou não à AIDS, que persistia ao longo do tempo. Essa alteração foi independentemente associada a neoplasias, e permaneceu significativa mesmo após análise apenas de pacientes sob supressão virológica, e após exclusão de coinfecções pelos HBV e HCV.18 Por outro lado, também foi observada associação entre plaquetopenia, níveis de D-Dímeros, IL-6 e PCR-us e surgimento de neoplasias. Níveis de IL-6 foram preditivos de câncer apenas nos dois primeiros anos de seguimento. A figura 3 mostra estes dados.
Figura 3 HRs e IC 95% para cada tipo de câncer por intervalo de seguimento.
Em conjunto, esses dados sugerem que níveis elevados de D-Dímeros são importantes preditores de eventos adversos e mortalidade na população de pacientes vivendo com HIV-AIDS. A presença de replicação viral persistente parece ser um dos desencadeadores desse processo, assim como a inflamação resultante das alterações observadas nesses pacientes que contribuiriam para ocorrência de doença arterial, uma das principais causas reconhecidas de elevação de D-Dímeros. Isso ocorreria independentemente da idade do paciente, ou de comorbidades preexistentes, mas em estreita associação com os fenômenos inflamatórios observados nesses estudos.
A identificação e validação de marcadores biológicos pode ser uma importante ferramenta no manejo dessas comorbidades, facilitando o desenho de estratégias para seu manejo adequado.
Por outro lado, as evidências disponíveis ainda falham em demonstrar uma clara relação de causalidade entre esses marcadores e os eventos associados. Embora estudos recentes tenham abordado esses problemas de modo mais objetivo, casuísticas limitadas e diferentes abordagens metodológicas limitam o alcance dessas conclusões. A identificação e validação de marcadores biológicos pode ser uma importante ferramenta no manejo dessas comorbidades, facilitando o desenho de estratégias para seu manejo adequado. Estudos mostrando intervenções capazes de modificar esses desfechos, por meio da inibição da inflamação sistêmica, podem ajudar a definir o verdadeiro papel desses marcadores na prática clínica (tabela 2).