Introdução
A terapia antirretroviral (TARV) vem apresentando avanços importantes nos últimos anos, com o acréscimo de novas drogas e classes que ampliaram de modo significativo nossas opções para tratamento da infecção pelo HIV-1. O guia do Department of Health and Human Services (DHHS), em sua última edição, enfatiza que, atualmente, devido a esses avanços, a maioria dos pacientes consegue atingir supressão virológica sustentada, e que necessidades individuais podem levar à troca dos esquemas ARV em uso, no sentido de atender às características de cada paciente.1 A tabela 1 resume as principais razões que levam à substituição de um esquema ARV por outro mais adequado a um determinado paciente.
Entretanto, em qualquer troca existem riscos que podem comprometer a segurança e a eficácia do switch. A substituição de um esquema por outro contendo novos agentes pode estar associada à emergência de toxicidade pela nova droga introduzida. Além disso, em pacientes com histórico prévio de falhas, a resistência arquivada (mesmo que não seja aparente no teste de genotipagem) pode comprometer a eficácia do novo esquema, resultando em maior chance de falha. A troca para simplificação (usar esquema de drogas combinadas em pílula única) pode impossibilitar correções de doses, quando necessárias, dificultando a utilização do novo esquema. E, finalmente, a troca de esquemas pode induzir o paciente a erros na dispensação dos novos medicamentos ou de tomada, uma vez que ele está habituado à prescrição anterior. Muitas vezes, o próprio paciente se opõe à troca, alegando que está bem-adaptado ao tratamento atual, mesmo quando seu médico vê benefícios inequívocos na troca. Além disso, a troca pode encarecer o custo do tratamento, um resultado inverso ao esperado para o switch ideal.
Assim, existem princípios básicos que devem guiar qualquer tentativa de switch. São eles:2
• Manutenção da supressão viral;
• Histórico de tratamentos prévios;
• Documentação de resistência prévia possível ou provável, baseada na história do paciente;
• Probabilidade de adesão ao novo tratamento;
• Probabilidade de eventos adversos com a nova terapia e sua aceitação pelo paciente;
• Potenciais interações medicamentosas com o novo esquema; e
• Custo.
Questões a considerar antes de considerar o switch:
• A regra básica a ser seguida antes de fazer uma troca de medicamentos é a garantia de manutenção da supressão virológica. Torna-se de fundamental importância a revisão do histórico de tratamento do paciente, para a correta avaliação do risco de falha secundária a mutações de resistência acumuladas. Quando o paciente encontra-se em uso de seu primeiro esquema, sem nunca ter apresentado falha terapêutica, é muito mais simples efetuar a troca, pois as possibilidades de substituição de uma ou mais drogas antirretrovirais são variadas. Entretanto, quando o paciente tem histórico de uso de mono ou dupla terapia, ou falhas a esquemas prévios, deve-se evitar a troca, a menos que exista toxicidade aparente e incontornável com o esquema atual.
• Uma vez definida a troca, devemos considerar o momento mais adequado para sua execução. Caso o paciente apresente quadro de toxicidade importante, devese fazer a troca imediatamente. Entretanto, nos casos em que o paciente encontra-se estável, sem urgência na modificação do esquema em uso, a troca pode ser planejada, sem necessidade de mudança imediata. Nesses casos, deve-se garantir um tempo de carga viral indetectável superior a seis meses (quanto mais longo, melhor!), no sentido de reduzir o risco de rebote viral. A troca não deve ser feita nos momentos em que outras modificações terapêuticas estejam ocorrendo; por exemplo, durante o período de introdução/mudança de tratamentos para comorbidades. Uma vez efetuada a troca, devese monitorar precocemente a carga viral, de maneira a modificar o esquema rapidamente, caso ocorra falha virológica1,2
• Um ponto importante a ser considerado é a posição do paciente com relação às mudanças em seu tratamento. É desejável que ele esteja de acordo com a mudança e convencido de que é a mais adequada ao seu momento atual. Devese enfatizar a necessidade de atenção para mudanças na posologia e a possibilidade de ocorrência de novos efeitos adversos, decorrentes da troca.
A regra básica a ser seguida antes de fazer uma troca de medicamentos é a garantia de manutenção da supressão virológica
Tipos de switch possíveis, na atualidade
Tipicamente, observamos a troca de um antirretroviral específico como o procedimento mais comum. Esta troca pode se concentrar nos inibidores da transcriptase reversa análogos de nucleosídeos (ITRN) ou não análogos (ITRNN), ou incluir a substituição do inibidor da protease (IP). Os ITRNs mais antigos são habitualmente candidatos à troca, devido ao seu perfil de toxicidade ou à posologia pouco cômoda. A estavudina (d4T) e a didanosina são exemplos claros de drogas que perderam espaço no arsenal terapêutico atual, devido à toxicidade. Em menor escala, a observação é semelhante em relação à zidovudina (AZT), ao tenofovir (toxicidade renal) e ao abacavir (ABC), em consequência de sua associação com risco cardiovascular.
No caso dos ITRNN, as mudanças também ocorrem devido à toxicidade para o sistema nervoso central (SNC) (efavirenz) ou à comodidade posológica (nevirapina). Os IP podem ser trocados para redução ou eliminação do ritonavir (apenas atazanavir propicia esta opção), para simplificação da terapia (redução do número de tomadas diárias ou monoterapia com IP) ou troca para outra classe (habitualmente, ITRNN ou inibidores da integrasse). Por vezes, opta-se pela eliminação da terceira droga, com a utilização de esquemas baseados apenas em IP + lamivudina (3TC).2
Estudos recentes de switch
Troca de ITRNN ou IP/r por INI
O estudo STRATEGY-NNRTI incluiu pacientes estáveis, com carga viral indetectável por um mínimo de seis meses, em uso de ITRNN+TDF+FTC. Os pacientes foram randomizados para permanecerem com o esquema original ou mudarem para uma combinação de EVG+CBC+TDF+FTC (dose fixa combinada). No momento de entrada no estudo, 78% utilizavam EFV; 17%, NVP; 4%, RPV; e < 1%, ETR. Quase todos os incluídos no estudo (91%) usavam o primeiro esquema antiretroviral.3
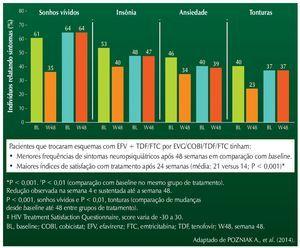
Após 48 semanas, observou-se maior satisfação com a terapia nos pacientes que trocaram o esquema, e redução significativa dos sintomas relacionados ao SNC, como sonhos vívidos, insônia, ansiedade e tonturas. Todas as alterações foram estatisticamente significativas. Falha virológica ocorreu em três pacientes no grupo EVG, e em um paciente no grupo EFV. Não foi detectada resistência em nenhum caso. A figura 1 resume os achados do estudo.
Figura 1 STRATEGY-NNRTI: desfechos em pacientes que trocaram esquemas antirretrovirais baseados em efavirenz.
No tocante aos distúrbios lipídicos, não foram observadas diferenças significativas entre os grupos, exceto para o colesterol HDL, que apresentou redução significativa no grupo que substituiu EFV por EVG.
O estudo SPIRAL avaliou os desfechos da troca de esquemas baseados em IP/r por raltegravir (RAL). Os pacientes estavam, em média, há 6,6 anos com carga viral indetectável, e foram randomizados para permanecerem em uso do esquema original ou trocarem o IP/r por RAL, 400 mg/2x dia. Após um ano de seguimento, não houve diferença entre os grupos no tocante à falha virológica (quatro falhas no grupo RAL, contra seis no grupo IP), embora o grupo que trocou para RAL não tenha apresentado mutações de resistência, enquanto no grupo IP, três pacientes apresentaram mutações na protease e/ou transcriptase do HIV-1.4 Um subestudo (SPIRAL-LIP) avaliou o impacto da troca sobre a densidade mineral óssea, e concluiu que a troca para RAL foi associada à melhora na DMO em colo de fêmur e fêmur total (mas não em coluna lombar), enquanto o grupo que manteve uso do IP/r não apresentou modificação óssea significativa.5
Outro estudo (STARTMRK), realizado na mesma época, comparou a eficácia virológica da substituição de esquemas baseados em lopinavir/ritonavir (LPV/r) por RAL. Uma diferença significativa em relação ao SPIRAL era o tempo mínimo de carga viral indetectável requerido para entrada no estudo: apenas três meses. Os resultados após seis meses de seguimento mostraram desempenho inferior do esquema baseado em RAL, mas quando a comparação era feita apenas com pacientes que utilizavam o primeiro esquema com LPV/r, a diferença desaparecia, sugerindo que mutações acumuladas em falhas prévias comprometiam a eficácia da troca, além do curto tempo de carga viral indetectável. Este dado reforça a necessidade de avaliarmos cautelosamente os pacientes candidatos a switch, especialmente para esquemas com barreira genética baixa (como RAL+TDF+FTC).6
O estudo STRATEGY-PI seguiu o modelo do estudo com ITRNN: pacientes com supressão virológica superior a seis meses, em uso de esquemas baseados em IP/r foram randomizados para permanecerem em uso do esquema original ou trocarem para EVG+CBC+TDF+FC. A maioria (79%) dos pacientes utilizava o primeiro esquema ARV ao ser incluída no estudo. Os IPs previamente utilizados foram: ATV, 40%; DRV, 40%; LPV, 17%; FPV, 3%; SQV, < 1%. As taxas de interrupção devido a eventos adversos foram similares, com cinco casos no grupo de troca, contra dois no grupo IP/r. A eficácia virológica após 48 semanas favorecia o grupo EVG (94%), em comparação com o grupo IP/r (87%). Observou-se redução significativa nas taxas de triglicérides no grupo que usou EVG, e nos níveis de colesterol total, triglicérides e HDL quando a comparação era feita apenas com os que mantiveram LPV/r como o IP inicial. Houve elevação nos níveis de HDL nos pacientes que utilizavam DRV/r.7
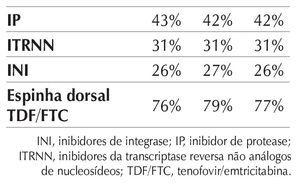
Mais recentemente, o estudo STRIIVING foi desenhado para avaliar a troca de pacientes em diferentes esquemas ARV (baseados em IP/r, INI, ou ITRNN) para uma combinação fixa de dolutegravir (DGV)+ABC+3TC (esquema poupador de TDF).8 O estudo previa a randomização inicial dos pacientes para o grupo troca ou a manutenção do esquema em uso. Após seis meses, todos os pacientes passavam a utilizar a combinação de DTG+ABC+3TC. Os dados preliminares apresentados no Interscience Conference of Antimicrobial Agents and Chemotherapy (ICAAC) 2015 mostravam que, no momento basal, a distribuição dos pacientes de acordo com os esquemas antirretrovirais utilizados era:
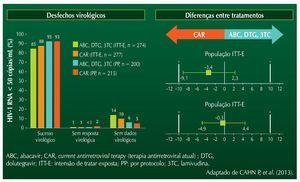
Os resultados após seis meses de tratamento são mostrados na figura 2.
Figura 2 Desfechos na semana 24 (Snapshot): populações ITT-E e PP.
Não foram detectadas falhas virológicas em participantes do estudo (ambos os braços). A interrupção de tratamento no grupo DTG se deu, basicamente, devido a eventos adversos de leve intensidade. Foi detectada uma taxa significativamente maior de satisfação com o tratamento no grupo que usou DTG. As alterações nos níveis séricos de lípides foram idênticas nos dois braços do estudo, mas observou--se uma leve elevação nos níveis de creatinina sérica nos pacientes que usaram DTG. Esta alteração foi observada no início do tratamento e manteve-se estável até a avaliação, ao final de seis meses.8
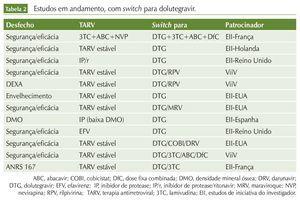
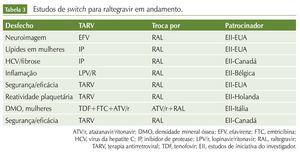
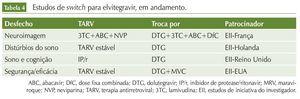
Além desses estudos, existem vários protocolos clínicos em andamento, abordando a troca de esquemas variados por INI. Em sua maioria, são estudos de iniciativa de investigadores, financiados pelas companhias farmacêuticas. As tabelas 2, 3 e 4 resumem esses dados.
Um pequeno estudo (n = 16) que avaliou o impacto da troca de esquema ARV por terapia dupla com RAL+MRV mostrou a ocorrência de redução da relação CD4/ CD8 e elevação nos sinais de ativação imune (células CD8), associados a uma redução na proporção de monócitos clássicos, consequente ao aumento na proporção de monócitos pró-inflamatórios. Estes dados correlacionaram-se negativamente com a carga viral, mostrando que esta troca provavelmente levou à pequena perda no controle da carga viral plasmática, induzindo perfil pró-inflamatório.9
Outro estudo (ROCnRAL ANRS-157) com pequeno tamanho amostral (n = 44) avaliou a troca do esquema em uso para RAL+MRV, em pacientes com supressão viral. Novamente, observou-se que esta troca falhava em manter a supressão virológica. Um dado interessante deste estudo é que os autores não conseguiram identificar fatores preditivos de falha entre os participantes, mesmo quando foram utilizados métodos sofisticados, como sequenciamento ultraprofundo (ultra-deep sequencing) da integrase e do envelope viral.10
Os ITRNN mais recentes (ETV e RPV) habitualmente apresentam menor número de efeitos colaterais que os de primeira geração
A troca de IP/r por RAL também foi avaliada em mulheres, como estratégia para reduzir o acúmulo de gordura visceral em pacientes com adiposidade central. Após 24 meses, observou-se impacto favorável nos níveis de lípides séricos, e após 48h uma redução de 6,4% no tecido adiposo visceral, mas sem atingir significância estatística.11
Estudos de troca para rilpivirina ou etravirina
Os ITRNN mais recentes (etravirina – ETV, e rilpivirina – RPV) habitualmente apresentam menor número de efeitos colaterais que os de primeira geração, além de perfil metabólico mais favorável que EFV ou IP. Em 2015, Gazaignes et al. publicaram os resultados de um estudo retrospectivo que avaliou a troca de TARV em pacientes com falhas a esquemas anteriores, mas indetectáveis durante o tratamento atual. Os pacientes (n = 281) substituíram o esquema em uso pela combinação de RPV+TDF+FTC. Após 12 meses, 59% dos pacientes mantinham sucesso virológico, taxa que elevou para 72% após esse período. Os autores concluíram que switch de pacientes com supressão virológica estável para esquemas baseados em RPV somente deve ser cogitado naqueles sem falhas a esquemas prévios e sem evidências de mutações de resistência aos ITRN e ITRNN.12
Outro estudo retrospectivo, conduzido na França, avaliou a troca de esquemas ARV variados para uma combinação de RPV+TDF+FTC (dose fixa combinada).
Todos os 304 pacientes incluídos tinham supressão virológica estável. Destes, 116 foram selecionados para troca de esquemas devido à toxicidade (principalmente relacionada ao EFV, em 59 pacientes); enquanto em 224 casos buscou-se simplificação da terapia. Após 12 meses da troca, 93,4% dos pacientes permaneciam com carga viral indetectável, sem alterações significativas na contagem de células CD4. Foi observada melhora dos níveis séricos de lípides e da tolerabilidade em 29,9% dos pacientes. Entretanto, foi detectada redução significativa na taxa de filtração glomerular (-11 mL/min). O estudo concluiu pela eficácia deste tipo de switch, com melhora da tolerabilidade.13
A troca para esquemas baseados em ETV foi avaliada em estudo da Swiss HIV Cohort. Pacientes em uso de estatinas foram selecionados para trocar IP/r ou EFV por ETV, caso apresentassem níveis de LDL elevados. Dos 31 pacientes envolvidos neste estudo, 68% utilizavam ETV e 32%, IP/r. Após interrupção das estatinas em uso (quatro semanas), a substituição dos ARV era efetuada. Dentre os 27 pacientes submetidos ao switch, os níveis séricos de marcadores de risco cardiovascular (sICAM e MCP1/CCL2) foram significativamente reduzidos, com elevação de CCL5/ RANTES. As conclusões do estudo indicam que substituição de IP/r ou EFV por ETV é uma estratégia viável para evitar a utilização de estatinas.14
Switch de IP/r e estudos de simplificação
Embora d4T e AZT sejam ARV em desuso, ainda existe um contingente significativo de crianças utilizando esquemas baseados nestes ITRN de primeira geração. Um estudo recente, conduzido por Saez-Llorens et al., avaliou a troca de AZT ou d4T por TDF em 98 crianças de 2 a 16 anos de idade. Após 24 e 48 semanas, não foi observada diferença significativa entre as taxas de supressão virológica para os grupos avaliados.15
Outro estudo voltado para a troca de drogas da espinha dorsal do esquema também foi publicado em 2015. Pacientes em uso de AZT+3TC ou TDF+FTC foram randomizados para permanecerem usando o esquema original ou substituírem a espinha dorsal por ABC+3TC. Foram avaliados marcadores inflamatórios e citocinas. Após um ano, a troca foi considerada bem-sucedida na manutenção da supressão virológica e dos níveis de CD4, mas pacientes em uso de AZT apresentaram elevação significativa nos níveis de adiponectina, colesterol total e creatinina. A troca para ABC+3TC foi considerada eficaz e segura.16
A troca de IP por drogas da mesma classe ou de classes diferentes também é uma estratégia frequente de switch, seja para simplificar a TARV, seja para reduzir efeitos adversos destas drogas. A troca de LPV/r por outro IP tem sido recorrente nestes estudos. O ATAGLU, por exemplo, avaliou os efeitos da substituição do LPV/r, em pacientes com supressão virológica estável por ATV/r ou ATV. Após um ano de seguimento, observou-se redução significativa dos níveis séricos de glicose e insulina, de colesterol e triglicérides, sem afetar o ganho de CD4 e a supressão virológica.17 No estudo OLE, optou-se pela simplificação da TARV, com retirada da terceira droga, mantendo apenas LPV/r+ 3TC. Não houve alterações nas taxas de sucesso virológico após um ano.18
No estudo AtLaS, a simplificação foi efetuada em pacientes utilizando esquemas combinados com base em ATV/r, em estratégia semelhante à do OLE, na qual foi retirada a terceira droga e mantido o ATV/r+3TC. Após 144 semanas, observou-se manutenção da eficácia virológica, elevação dos níveis de colesterol, da taxa de filtração glomerular e da DMO da coluna lombar, com redução da gordura central. Os autores ressaltam a necessidade de mais testes com esta estratégia, devido aos potenciais benefícios.19
Atazanavir é o único dos IP em uso na atualidade que permite a eliminação do ritonavir como reforço. Dois estudos avaliaram a eficácia da estratégia de utilização do ATV sem reforço de ritonavir e seu impacto sobre os principais parâmetros metabólicos. O estudo LAREY avaliou a segurança e eficácia da retirada da terceira droga em pacientes utilizando esquema triplo, baseado em ATV sem reforço de RTV. Os pacientes eram mantidos com ATV/3TC ou ATV/FTC. Após um ano, não ocorreu perda da supressão virológica, atestando a segurança da troca.20 O segundo estudo, da coorte EuroSIDA, avaliou pacientes que utilizavam IP/r e que tiveram seus esquemas modificados para ATV/ ABC/3TC. Após um ano, não houve aumento nas taxas de falha virológica ou no surgimento de eventos adversos novos. Os autores sugerem que este tipo de switch pode ser utilizado com segurança, principalmente em pacientes com longo tempo de estabilidade terapêutica.21
Finalmente, o estudo SWITCHART avaliou retrospectivamente 246 pacientes submetidos à troca de medicação devido à toxicidade, ou para simplificação. Os participantes foram divididos em três grupos: troca para monoterapia com IP/r, troca para IP/r + MRV ou troca para 2 ITRN+1 ITRNN. Toxicidade renal ou do SNC e diarreia foram as causas mais frequentes de troca, devido a problemas de tolerabilidade. Os problemas de toxicidade foram completamente resolvidos em 66% dos pacientes, e parcialmente em 22% deles. Apenas 12% não apresentaram melhoras. Monoterapia com IP/r (principalmente DRV/r) e dupla terapia foram os esquemas mais frequentemente utilizados na substituição do esquema original. A conclusão do estudo foi que a troca resolve a maior parte das toxicidades da TARV, em curto prazo.
Conclusões
A troca dos esquemas antirretrovirais em uso pode ser uma estratégia de simplificação da TARV, melhorando a adesão, e, em alguns casos, reduzindo a ocorrência de eventos adversos secundários a drogas específicas. Uma vez que o arsenal terapêutico atual é bastante diversificado, esta troca pode ser efetuada com segurança, sem risco de perda da eficácia virológica. A adequada seleção do paciente com indicação de troca e dos medicamentos que podem ser substituídos é fundamental para o sucesso desta estratégia. Deve-se observar o princípio básico de preservar a supressão virológica como requisito essencial para uma troca bem-sucedida.