A 21ª International AIDS Conference, que ocorreu em Durban, África do Sul, entre 18 e 22 de julho deste ano, foi marcada pelas comparações entre a versão atual do even-to e a Conferência ocorrida no ano 2000, na mesma cidade. Naquela época, a epidemia de AIDS explodia na África do Sul, não havia tratamento disponível no continente e as autoridades locais teimavam em negar o que estava acontecendo. A situação hoje é dramaticamente oposta: há 17 milhões de pessoas em terapia antirretroviral (TARV) no mundo – a maior parte desse contingente no continente africano, em especial na África do Sul –, com redução significativa dos óbitos relacionados à AIDS desde 2005.
Prevenção da infecção pelo HIV-1
Nesta conferência, pode-se dizer que estudos sobre a prevenção da infecção pelo HIV foram dominantes, especialmente no que se refere à profilaxia pré-exposição (PrEP). Os dados apresentados sobre os desfechos do estudo IPERGAY mostraram que, em sua fase aberta, a disponibilização de PrEP on demand reduziu o risco de infecção em 97% para os 336 participantes. O único caso de transmissão se deu em um paciente que havia interrompido o uso do tenofovir (TDF) + emtricitabina (FTC). A profilaxia foi bem tolerada, e observou--se uma incidência de uma nova DST em 39% dos casos, indicando que houve redução no uso de preservativos.1
O estudo PARTNERS, por sua vez, mostrou que a utilização da combinação de PrEP e TARV para casais sorodiscordantes no Quênia e em Uganda foi capaz de reduzir o risco de transmissão do HIV em 94%, e que essa proteção era sustentada ao longo do tempo de seguimento desse grupo.2 Nos EUA, um estudo conduzido por Hosek et al.3 avaliou a segurança de PrEP entre adolescentes americanos. O estudo incluiu 78 adolescentes heterossexuais, e a taxa de soroconversão foi de 6,41/100 pessoas/ano. A maioria relatou sexo sem proteção durante o estudo, e a principal razão para a não adesão à PrEP foi o medo de ser identificado como portador do HIV, devido ao uso das pílulas da PrEP.
O risco de emergência de resistência aos antirretrovirais para pacientes em uso de PrEP foi avaliado por um estudo conduzido pelo Dr. Robert Grant. Avaliando pacientes que se infectaram em uso de PrEP, ele demonstrou que ocorreu apenas um caso de resistência ao TDF em pacientes utilizando a profilaxia, e que tal caso foi detectado em um paciente com infecção aguda, no momento de início da PrEP, não detectada pelo estudo. Não foram registrados casos de resistência nas infecções que emergiram durante o curso do protocolo.4
Finalmente, um estudo conduzido no Haiti comparou a estratégia de iniciar a TARV no mesmo dia em que o paciente recebia o diagnóstico de infecção pelo HIV-1 com o procedimento habitual, de fazer uma avaliação mais detalhada e iniciar TARV nas visitas subsequentes (até 90 dias). Os resultados obtidos mostraram que a estratégia de início imediato da TARV (mesmo dia) resultou em taxas significativamente maiores de retenção e de início da TARV, e, portanto, deveria ser uma alternativa eficaz aos protocolos de avaliação inicial para os pacientes recém-diagnosticados.5
Uma abordagem inovadora para pre vençãoda infecção pelo HIV-1 em mulheres utilizou anéis vaginais impregnados com dapivirina.
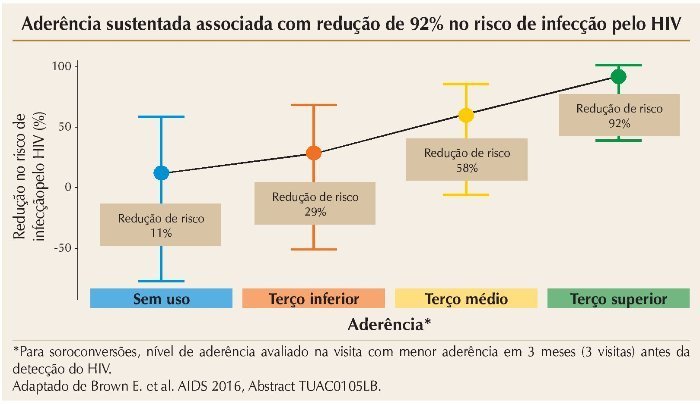
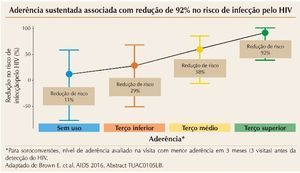
Uma abordagem inovadora para prevenção da infecção pelo HIV-1 em mulheres utilizou anéis vaginais impregnados com dapivirina, um inibidor da transcriptase re-versa não nucleosídio, na dose de 25 mg. A utilização adequada do anel reduziu o risco de infecção em 65%. Para pacientes com adesão intermediária ou não aderentes, a redução no risco foi de 56 e 31%, respectivamente.6 A figura 1 resume esses achados.
Figura 1. MTN-020/ASPIRE Subcohort: Aderência vs. proteção contra o HIV três meses antes da detecção.
Embora a Conferência não tenha apresentado muitos trabalhos sobre utilização de vacinas experimentais, um estudo de fase I/II, duplo cego, controlado por placebo, avaliou a capacidade de uma vacina experimental, baseada em subtipo C ALVAC-HIV, e gp120/MF59 bivalente para o subtipo C, em atingir quatro critérios de imunogenicidade requeridos para que o produto passasse a fases mais avançadas (IIb) de estudos. A vacina foi capaz de atingir eficientemente os quatro objetivos (desenvolver anticorpos IgG capazes de se ligar a ≥ 2 de 3 antígenos vacinais gp120; exibir capacidade de ligação de anticorpos aos antígenos vacinais gp120 não inferior a testes vacinais prévios com RV 144; exibir resposta de células CD4+ específicas para Env, expressando IL-2, IFN-gama ou CD40L vs. RV144, com diferença de no máximo 30%; e desenvolver anticorpos IgG capazes de se ligar a mais de um antígeno V1V2 do subtipo C viral). Uma vez que o protótipo vacinal foi aprovado em relação a esses requisitos, a vacina será testada em estudos de fase IIb, na sequência.7
Estudos com novas drogas/ estratégias de tratamento
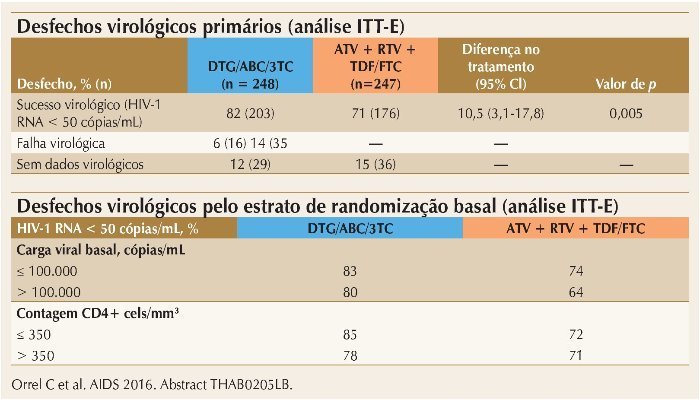
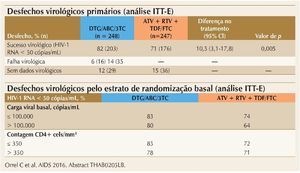
Vários estudos sobre avanços na TARV foram apresentados durante a Conferência. Um deles, o estudo ARIA, comparou esquemas baseados na combinação de dolutegravir (DTG) + abacavir (ABC) + lamivudina (3TC) com a combinação de atazanavir/ ritonavir (ATV/RTV) + TDF + FTC, para tratamento inicial de mulheres infectadas pelo HIV-1. O estudo foi multinacional, randomizado, aberto, de fase IIIb, e incluiu 248 mulheres em cada braço. Os resultados finais mostraram superioridade da resposta virológica do esquema com DTG, em comparação com ATV/RTV, com diferença de resposta de 10,5% favorecendo o braço DTG. A resposta foi consistentemente maior no braço DTG para todos os estratos de carga viral (maior ou menor que 100.000 cópias/mL) e de CD4. A figura 2 resume esses achados. A tolerabilidade foi semelhante para ambos os braços, exceto para icterícia – presente apenas nos pacientes que utilizaram ATV/RTV.8
Figura 2. ARIA: DTG/ABC/3TC superior a ATV + RTV + TDF/FTC após 48 semanas.
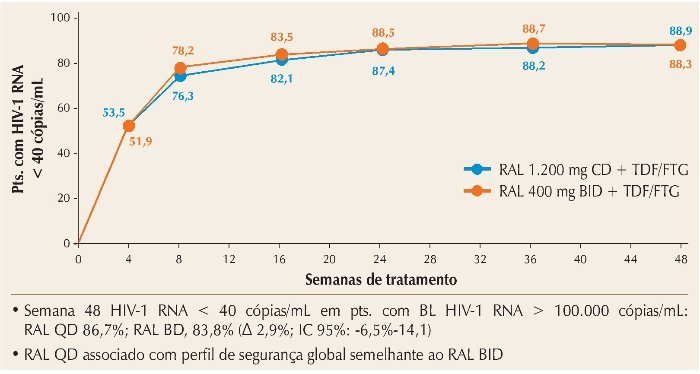
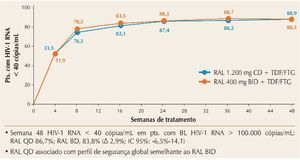
O estudo ONCEMRK avaliou a utilização de dose única diária de raltegravir (RAL) – 1.200 mg, divididos em dois tabletes de 600 mg –, em comparação com a dose padrão de 400 mg duas vezes ao dia, e concluiu pela não inferioridade da nova apresentação, como mostrado na figura 3.9 O perfil de tolerabilidade foi similar para as duas formulações do RAL, evidenciando que a dose única diária pode ser uma alternativa aos esquemas atuais.
Figura 3. ONCEMRK: RAL 1200 mg QD não inferior a RAL 400 mg 2×/dia após 48 semanas.
Os resultados finais mostraram superioridade da resposta virológica do esquema com DTG, em comparação com ATV/RTV.
Outro estudo envolvendo o DTG (estudo STRIIVING) avaliou a troca de esquemas antirretrovirais de pacientes com supressão virológica estável há pelo menos seis meses por uma combinação fixa de DTG + ABC + 3TC. Os resultados do estudo, após um ano de seguimento, mostraram que não foram detectadas falhas virológicas, conforme definição do protocolo, após 48 semanas de seguimento, com altas taxas de supressão viral para os que trocaram a TARV precocemente (83%) ou tardiamente (92%).
Uma apresentação que atraiu bastante atenção mostrou os resultados do estudo LATTE 2. Esse estudo comparou a utilização de medicamentos injetáveis (cabotegravir 400 mg + rilpivirina (RPV) 600 mg a cada quatro semanas; cabotegravir 600 mg + RPV 900 mg a cada oito semanas) vs. cabotegravir + ABC + 3TC via oral, diariamente. Após 96 semanas, a eficácia virológica da utilização das medicações injetáveis foi similar à observada para o esquema oral. Os eventos adversos mais comuns foram reações no local da injeção, que levaram à interrupção do tratamento em < 1% dos pacientes. A figura 4 resume os resultados do estudo.10
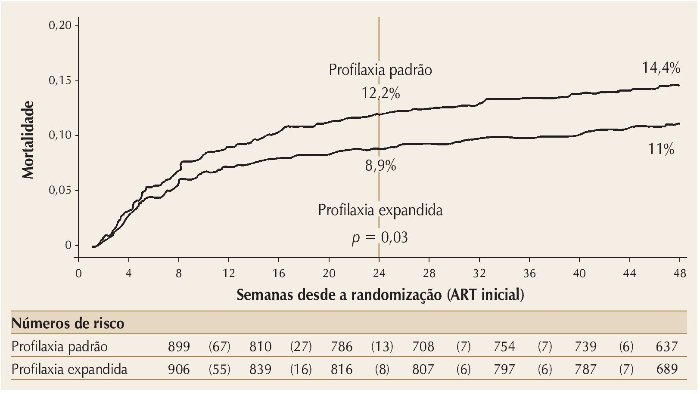
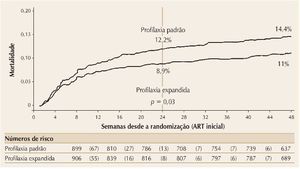
Figura 4. Taxas de mortalidade para pacientes que receberam profilaxia padrão contra infecções oportunistas vs. profilaxia expandida após 24 semanas.
As mulheres que mantiveram a TARV apresentaram uma redução significativa de eventos relacionados à AIDS.
Outra abordagem interessante foi mostrada pelo estudo PROMISE, conduzido em diversos países, entre os quais o Brasil. O objetivo primário era avaliar a segurança e eficácia de manter os antirretrovirais após o término da gestação, em comparação com a interrupção do tratamento após o parto. As mulheres que mantiveram a TARV apresentaram uma redução significativa de eventos relacionados à AIDS (razão de risco -0,47, IC 95% 0,32-0,68). Não houve diferença significativa entre os grupos no que diz respeito aos desfechos primários de segurança e eficácia. Entre as mulheres que continuaram o tratamento, a taxa de falha virológica foi de 23%, com detecção de resistência em 34% dos casos de falha.11
Dois estudos envolvendo terapia dupla com esquemas baseados em DTG foram apresentados. Em uma abordagem conduzida por Diaz e cols. foi demonstrado que pacientes com supressão virológica estável por longo período e pelo menos uma falha a esquemas prévios podiam trocar o esquema em uso por uma combinação de DTG + RPV. Os pacientes eram candidatos à troca por razões de interações medicamentosas, toxicidade ou por necessidade de simplificação. Após 48 semanas, 92% dos 38 pacientes envolvidos permaneciam com carga viral indetectável, sem nenhuma falha virológica documentada (troca por toxicidade, interações indesejáveis ou decisão do médico). Observou-se melhora na função hepática e nos níveis de lípides, sem alteração da função renal.12
O PADDLE mostrou uma abordagem diferente, com pacientes virgens de tera pia, em um estudo exploratório de fase IV.
O PADDLE mostrou uma abordagem diferente, com pacientes virgens de terapia, em um estudo exploratório de fase IV, conduzido pelo Dr. Pedro Cahn. Os pacientes receberam a combinação de DTG + 3TC. Após 48 semanas, não foram detectadas falhas virológicas, com 18/20 pacientes remanescentes no estudo com carga viral indetectável.13
Tratamento do coinfectado HIV-HCV
Foram apresentados os resultados preliminares do ASTRAL5, um estudo multicêntrico de fase III de braço único. Nele, 106 pacientes coinfectados pelo HCV, genótipos 1 a 4, foram tratados com a combinação de sofosbuvir (SOF) + velpatasvir (VEL) durante 12 semanas. A taxa de resposta virológica sustentada foi superior a 90% para todos os subtipos (tabela 1). Observou-se interação medicamentosa importante com efavirenz (EFV)/TDF/FTC, que ocasionou redução de 50% na exposição de VEL. O estudo concluiu pela contraindicação da utilização de esquemas baseados em VEL para pacientes em uso de EFV. Por outro lado, a exposição do TDF foi elevada (níveis variando de 20 a 81%), o que sugere cautela na coadministração dessas duas drogas. Não se observou alteração significativa nos níveis de FTC, EFV, RPV, DTG, RAL, elvitegravir, ATV, RTV, darunavir e lopinavir.14,15
Dados do estudo TURQOISE-I parte 2 também mostraram que pacientes coinfectados pelo HCV, genótipos 1 ou 4, tratados com OBV/PTV/RTV ± DSV ± RBV, de acordo com o genótipo do HCV, apresentaram resposta virológica sustentada (RVS) de 97% (genótipo 1) e 96% (genótipo 4).16 Pacientes com infecção aguda pelo HCV, tratados por seis semanas com a combinação de SOF + ledipasvir (LED), apresentaram 77% de RVS após 12 semanas. Houve quatro falhas virológicas (uma reinfecção), com dois pacientes com perda de seguimento. Três dos pacientes com falha apresentavam carga viral basal do HCV > 7log10 UI/mL.17,18
Estamos avançando gradualmente para a otimização do manejo dos pacientes infectados pelo HIV, com uso de esquemas cada vez mais seguros e eficazes.
Outros estudos
Um subestudo do protocolo START buscou avaliar quais seriam os grupos com maior benefício para início precoce da TARV. Dentre os quase 5.000 participantes seguidos, em média, por três anos, observou-se uma redução na taxa de eventos (risco absoluto) durante o seguimento nos pacientes com início precoce da TARV (0,6/100 pessoas/ano), em comparação com os que iniciaram TARV tardiamente (1,38 eventos/100 pessoas/ano). Enquanto não foram observadas diferenças significativas nas taxas de eventos para oito subgrupos avaliados, a redução de risco foi maior para os pacientes com idade superior a 50 anos, para aqueles com carga viral inicial > 50.000 cópias/mL e para os pacientes com maior escore pela escala de Framingham. Observou-se ainda uma tendência de benefício entre os pacientes com menores valores de CD4.18
A avaliação do risco de suicídio para pacientes em uso de EFV foi apresentada em um trabalho do INSIGHT START Study Group. Não se observou relação entre risco de suicídio e grupo de tratamento (precoce ou tardio), mas pacientes que receberam esquemas baseados em EFV apresentaram risco de comportamento suicida significativamente maior em relação aos que não usavam TARV com esquemas sem EFV (HR = 4,16, p = 0,02). Por outro lado, pacientes que usaram esquemas sem EFV apresentaram risco similar ao observado entre controles que não estavam sob TARV (HR = 1,04, p = 0,9, p = 0,05 para comparação entre as HR). Um dado complementar mostrou que o risco era ainda maior em pacientes com histórico de problemas psiquiátricos.19
Finalmente, o estudo REALITY comparou esquemas de profilaxia padrão com ampliação para maior cobertura de infecções oportunistas em adultos e crianças menores de 5 anos de idade com estágios avançados de AIDS na África. Os pacientes foram randomizados para receber esquemas profiláticos habituais (cotrimoxazol + isoniazida/piridoxina) ou ampliados (cotrimoxazol + isoniazida/piridoxina + fluconazol + azitromicina/cinco dias + albendazol). Outras randomizações incluíram uso de RAL como terapia adjuvante nas primeiras 12 semanas de tratamento, e suplementação alimentar. O desfecho primário era a mortalidade após 24 semanas. A média da contagem de células CD4 era de 36/mm3. A utilização de profilaxia expandida resultou em redução significativa na mortalidade (12,2 para 8,9%, p = 0,02), incidência de tuberculose, doença criptocócica, candidíase oral/esofágica e mortes por causa desconhecida, mas não mortes por doença bacteriana. Uso de RAL não afetou a mortalidade.20 A figura 4 mostra o resumo das conclusões do estudo.
O balanço geral da Conferência evidencia claramente que estamos avançando gradualmente para a otimização do manejo dos pacientes infectados pelo HIV, com uso de esquemas cada vez mais seguros e eficazes. Além disso, as mais recentes estratégias de prevenção da infecção pelo HIV, notadamente em populações de maior risco, também mostram avanços significativos nessa área. Esses dados demonstram que HIV-AIDS continua sendo um campo extremamente dinâmico, e que a atualização do profissional que trabalha com esses pacientes é cada vez mais necessária.