Grandes avanços foram alcançados no tratamento do HIV/AIDS. Várias coortes ao redor do mundo mostram que em torno de 90% dos pacientes em tratamento estão com controle máximo da replicação viral. No Brasil, dados demonstram que 90% dos pacientes tratados com 18 anos de idade ou mais vivem com carga viral (CV) < 50 cópias/mL. O grande sucesso alcançado aumenta o nível de exigência para novos medicamentos. Exige-se potência com tolerabilidade e segurança e também a possibilidade de coformulação.
A busca por novos medicamentos no tratamento do HIV deve ser sempre justificada. A necessidade do desenvolvimento de medicamentos de novas classes é mais facilmente percebida pela ausência de resistência cruzada com as classes estabelecidas e pelo potencial de atividade nos pacientes em que as drogas disponíveis não fazem mais efeito. Mas, mesmo assim, os medicamentos de novas classes têm que passar por um alto crivo de eficácia e segurança. Por outro lado, novos medicamentos de classes já estabelecidas precisam provar muito mais: geralmente, buscam-se medicamentos com maior potencial de atividade frente a mutações de resistência às outras opções da mesma classe, e na ausência desses atributos é quase obrigatório apresentar maior eficácia e/ou segurança.
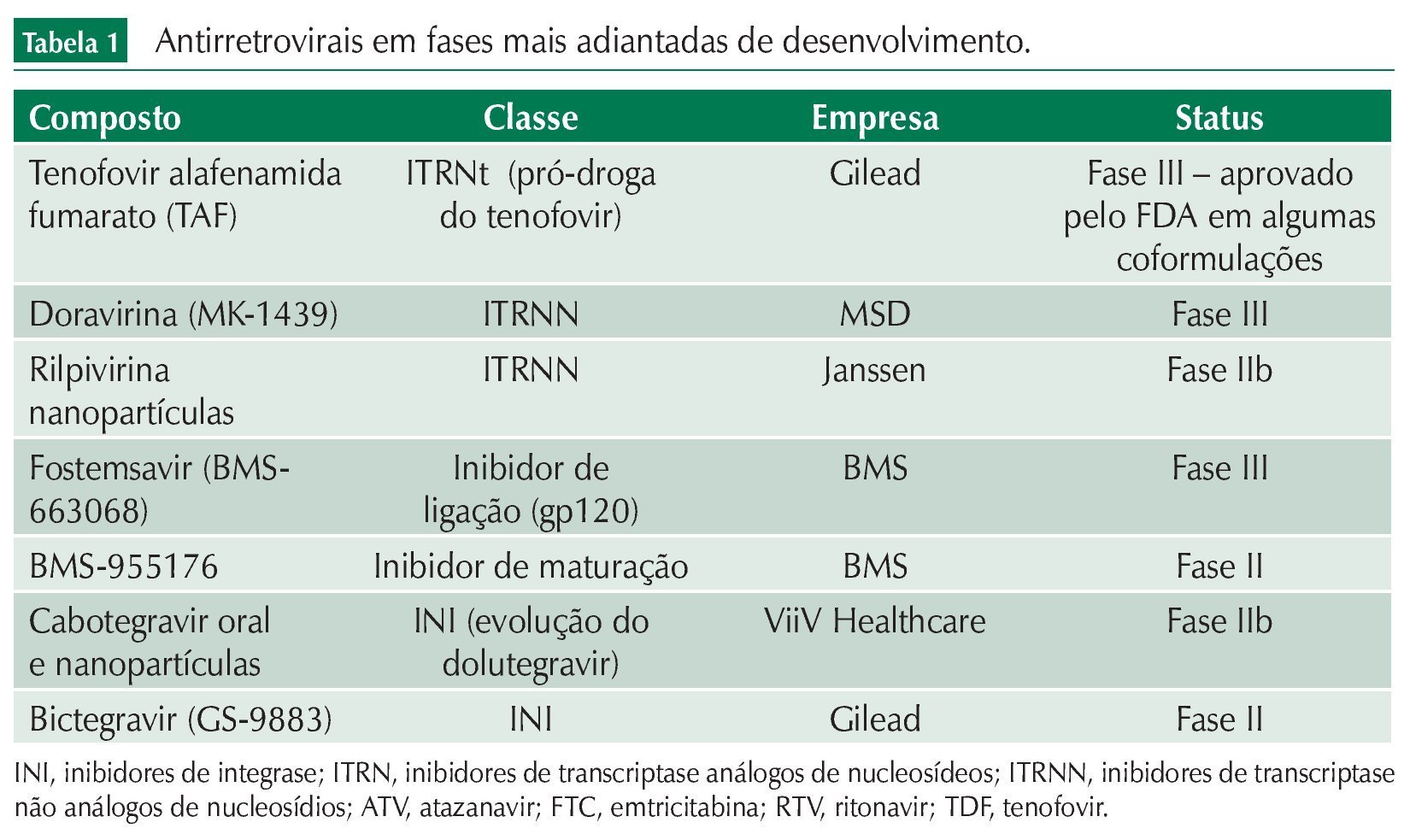
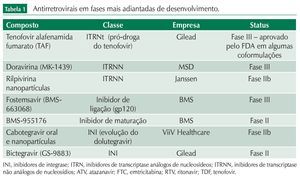
A tabela 1 exibe os medicamentos em fases mais avançadas de desenvolvimento.
A seguir, discutiremos mais detalhadamente cada um desses novos antirretrovirais.
Inibidor de transcriptase análogo de nucleosídeos
Com quase 30 anos de existência dos antirretrovirais, os inibidores de transcriptase análogos de nucleosídeos (ITRNs), primeira classe desenvolvida, ainda permanecem como base para a composição dos esquemas terapêuticos. Desse modo, a busca por compostos mais ativos e menos tóxicos é fundamental.
Nos últimos anos, quase toda a expectativa ficou centrada em uma pró-droga do tenofovir (TDF) que, por sua eficácia, é administrada em um décimo da dose do TDF, o que por sua vez facilita a coformulação e, por outro lado, reduz a toxicidade.
Tenofovir alafenamida
Desenvolvido para melhorar a atividade do TDF e diminuir sua toxicidade, o tenofovir alafenamida (TAF) hoje é aprovado pelo Food and Drug Administration, nos EUA, em três coformulações: TAF + emtricitabina (FTC) + rilpivirina (RPV) (Odefsey®); TAF + FTC + elvitegravir (EVG) + cobicistat (COBI) (Genvoya®); e TAF + FTC (Descovy®). Interessante notar que todos os produtos aprovados são coformulações.
O uso do TAF esteve associado com eficácia equivalente ao TDF e menor toxicidade óssea e renal
O uso do TAF esteve associado com eficácia equivalente ao TDF e menor toxicidade óssea e renal.1 Sua eficácia foi avaliada separadamente em quatro populações-chave: adultos sem tratamento prévio, adolescentes sem tratamento prévio, pacientes multiexperimentados (como switch) e pacientes com alterações renais.
Inibidor de transcriptase não análogo de nucleosídios
Os inibidores de transcriptase não análogos de nucleosídios (ITRNNs) perderam para os inibidores de integrase (INI) o posto de opção preferencial para início de tratamento em pacientes HIV positivos há algum tempo. O principal motivo tem a ver com a tolerabilidade, o que no longo prazo também reduz a eficiência do medicamento. Dessa maneira, novos ITRNNs têm sido buscados.
Doravirina
Esse ITRNN apresenta algumas características importantes: tem posologia única diária, não é nem indutor, nem inibidor de citocromo P450 (CYP3A4), e não apresenta interação com bombas de prótons.
A doravirina (MK-1439) está em avaliação em estudos fase II. A primeira parte desses estudos tentou definir a posologia diária do medicamento entre as seguintes dosagens: 25 mg, 50 mg, 100 mg e 200 mg. A dose escolhida para desenvolvimento futuro foi a de 100 mg/d. Na segunda parte do estudo, foram avaliadas a segurança e a eficácia da doravirina comparadas ao efavirenz (EFV), ambos combinados com TDF/FTC.2
Foram avaliados 132 pacientes sem tratamento prévio, com CV basal > 1.000 cópias/mL e CD4 > 100 células/mL, compondo um total de 66 pacientes para doravirina e 66 para EFV. Após 48 semanas, a taxa de pacientes com CV < 40 cópias/mL foi equivalente entre os braços – 77,8% para doravirina e 78,7% para EFV. Menos eventos adversos foram observados no grupo doravirina (31,5% versus 56,5%), principalmente relacionados a uma importante redução dos eventos neurossensoriais.
Inibidores de integrase
Os inibidores de integrase (INI) têm se destacado em relação a aspectos de segurança e eficácia. Assim, essa classe tem sido indicada como opção preferencial para o tratamento inicial dos pacientes com HIV. Temos como INI três medicamentos, todos com posologia simples de um a dois comprimidos/dia. Um deles exige intensificação farmacológica com COBI, e os outros dois existem em coformulação de um comprimido/dia. Desse modo, pouco pode ser alcançado em relação à melhoria das opções existentes.
Por outro lado, na busca por romper conceitos e propor novas opções de tratamento, encontra-se em desenvolvimento um novo INI de administração parenteral e de longa meia-vida, o cabotegravir (S/ GSK1265744). Esse INI apresenta estrutura química próxima ao dolutegravir (DTG) e tem sido testado em uma apresentação ligado a nanopartículas que aumentam a meia-vida do medicamento para 21 a 50 dias. Tal característica permite vislumbrar a possibilidade de administração em períodos prolongados de um mês ou mais.
Na busca por romper conceitos e propor novas opções de tratamento, encontra-se em desenvolvimento um novo INI de administração parenteral e de longa meia-vida, o cabotegravir
Cabotegravir
O cabotegravir tem sido estudado tanto para tratamento inicial quanto para prevenção do HIV. Os estudos de tratamento inicial foram feitos sobre o acrônimo LATTE (Long-Acting Antiretroviral Treatment Enabling) em estudos multicêntricos realizados no Canadá e nos EUA. Foram realizados dois estudos fase IIb.
O primeiro estudo foi uma prova de conceito utilizando uma formulação oral do cabotegravir,3 em que foram comparadas três posologias (10 mg, 30 mg e 60 mg) do cabotegravir oral versus EFV, todos combinados a dois ITRNs. Após 24 semanas, os pacientes em uso de cabotegravir e com CV indetectável foram alocados para uma extensão com esquema poupador de ITRNs com cabotegravir + RPV 25 mg/d por mais 72 semanas. A taxa de resposta com CV < 50 cópias/mL foi crescente conforme maior a dose do cabotegravir: 68% (15 mg), 75% (30 mg) e 84% (60 mg); e foi de 63% para o grupo EFV. Eventos adversos associados ao tratamento foram reportados para 51% dos pacientes de cabotegravir versus 68% dos pacientes com EFV. A frequência de saída dos estudos por eventos adversos também foi menor para cabotegravir (3%) versus EFV (15%).
Já o estudo LATTE II4 utilizou o cabotegravir e a RPV sob apresentação de nanopartículas. Foram avaliados 309 pacientes virgens de tratamento e com contagem de CD4 > 200 células/mL. Como no primeiro estudo, foi realizado um período de indução com cabotegravir 30 mg + abacavir (ABC)/lamivudina (3TC) por 20 semanas. A partir desse ponto foram comparadas três estratégias. A primeira, com 56 pacientes, avaliou a manutenção do cabotegravir e ABC/3TC por via oral. Os outros dois braços utilizaram a formulação de nanopartículas por via intramuscular com 600 mg/400 mg de RPV/cabotegravir a cada quatro semanas ou de 900 mg/600 mg de RPV/cabotegravir a cada oito semanas. Foi realizada uma análise na semana 32. Nesse ponto, 94% dos pacientes com uso de cabotegravir a cada quatro semanas versus 95% daqueles que fizeram uso a cada oito semanas versus 91% da formulação oral apresentavam carga viral indetectável. Apenas dois pacientes apresentaram critério de falha virológica na fase de manutenção (um deles no uso oral e outro no uso intramuscular a cada oito semanas – nesse segundo caso não foram detectados níveis de RPV no sangue nas semanas 4 e 8, sugerindo algum problema na administração da mesma). Em nenhum momento foram encontradas mutações de resistência a qualquer classe antirretroviral.
Bictegravir
O bictegravir (GS 9883) é uma evolução do EVG, porém não necessita de intensificação farmacológica. Ainda não teve dados amplamente divulgados, e está sendo comparado ao DTG para início de tratamento, ambos combinados a ITRNs.
O fostemsavir é o primeiro medicamento da classe de inibidores de ligação
Inibidores de maturação
Trata-se de nova classe de medicamentos. Há somente uma molécula em desenvolvimento mais avançado que tenta suplantar o beverimat, que foi um inibidor de maturação que teve estudos interrompidos após não apresentar a eficácia esperada em estudos fase II por polimorfismos na região GAG. Esses polimorfismos desfavoráveis foram observados em até 50% dos pacientes.
BMS-955176
Em um estudo fase II preliminar5 foi observado o efeito de duas dosagens desse medicamento associados ao atazanavir (ATV). Foram randomizados quatro braços: BMS-176 (40 mg) + ATV/ritonavir (300 mg/100 mg); BMS-176 (40 mg) + ATV (400 mg); BMS-176 (80 mg) + ATV (400 mg); e ATV/ ritonavir (330 mg/100 mg) + TDF/FTC. Os antirretrovirais foram administrados por 28 dias, porém foi observado efeito na redução da CV até o dia 42. A redução mediana na CV após 42 dias pode ser observada na tabela 2.
Não foram descritos eventos adversos sérios. Apenas um pacientes apresentou neutropenia transitória. Hiperbilirrubinemia foi detectada em 10 pacientes, porém foi descrita como leve na totalidade dos casos.
Inibidores de ligação
Pela primeira vez é desenvolvido um medicamento que tem como alvo uma fenda na GP120 que, uma vez coberta, leva à impossibilidade de o vírus se ligar ao CD4. Como inibe a ligação do HIV ao CD4, a atividade dessa molécula é independente do tropismo celular, pois se localiza no passo anterior à ligação no correceptor CCR5 ou CXCR4. Como depende de determinada característica conformacional da GP-120, não apresenta atividade no grupo O do HIV e nem no subtipo AE.
Fostemsavir
O fostemsavir (BMS-663068) é o primeiro medicamento da classe de inibidores de ligação. A maior expectativa é em relação à atividade em pacientes com opções limitadas de tratamento.
Em um primeiro estudo de definição de dose, o fostemsavir foi comparado em quatro braços versus ATV/r, sempre associados ao TDF + raltegravir (RAL).6 As doses utilizadas de fostemsavir foram 400 mg e 800 mg duas vezes/dia e 600 mg e 1.200 mg em dose única diária. Foram incluídos pacientes com experiência a pelo menos um antirretroviral prévio, mas que mostrassem atividade a todos os medicamentos do estudo em exame genotípico basal. Cada grupo contou com aproximadamente 50 pacientes. A taxa de pacientes com CV < 50 cópias/mL após 48 semanas foi de 91% (400 mg 2×), 73% (800 mg 2×), 69% (600 mg 1×), 79% (1.200 mg 1×) e 88% (ATV/r). Nesse estudo foi observada uma tendência a melhor resposta nos pacientes com contagem de CD4 > 200 células/mL. Mais recentemente, foram apresentados os resultados de 96 semanas desse estudo. A partir da semana 48, a dose de 1.200 mg em dose única diária foi selecionada e administrada a todos os pacientes do braço fostemsavir. Assim, na semana 96, 122 de 200 pacientes (61%) com fostemsavir + RAL + TDF alcançaram CV < 50 cópias/mL, enquanto no braço ATV/r + RAL + TDF, 27/51 (53%) atingiram essa resposta.7 Quanto à segurança, foi equivalente o número de eventos adversos sérios entre os braços (aproximadamente 13%), porém a descontinuação por evento adverso foi de 10% no grupo ATV/r versus 2,5% no grupo fostemsavir.
Apesar do enorme avanço alcançado no tratamento do HIV com a grande diversidade de opções terapêuticas, ainda existem novos alvos a serem perseguidos
Atualmente, está em andamento um estudo de fostemsavir para pacientes com falha a múltiplos tratamentos e de, no máximo, duas classes de antirretrovirais com atividade.
Considerações finais
Apesar do enorme avanço alcançado no tratamento do HIV com a grande diversidade de opções terapêuticas, ainda existem novos alvos a serem perseguidos. A evolução dos fármacos tem sido constante, tanto com o desenvolvimento de formulações mais potentes e menos tóxicas quanto com novos compostos mais toleráveis dentro de classes já existentes. A mudança de paradigma com o uso de antirretrovirais em nanopartículas com longa meia-vida pode revolucionar o tratamento antirretroviral e também a prevenção. Essa mudança de paradigma exigirá uma rápida adaptação das equipes, a fim de manter e ampliar os excelentes resultados encontrados hoje.